何爱彬研究组揭示不同区域单细胞通讯控制心脏发育的新机制
2019/06/28 信息来源: 分子医学研究所
编辑:凌薇 | 责编:山石6月21日,北京大学分子医学研究所、北京大学-清华大学生命科学联合中心研究员何爱彬研究组在Circulation Research杂志在线发表题为“Single-cell transcriptomics reveals chemotaxis mediated intra-organ crosstalk during cardiogenesis”的研究成果。先天性心脏病心脏结构发育畸形主要是由于第二心区来源的干细胞发育缺陷所致,然而精确调控分配这波干细胞的机制和理论却不清楚。该研究首次发现趋化作用介导了原始心管对这一波心脏干细胞迁移的直接调控作用,为理解早期心脏不同心区的发育和先心病的治疗提供了重要的理论依据。
心脏发育是一个极其复杂而又精确调控的过程,时空分配不同来源的心脏干细胞是正确形成心脏不同腔室和功能性亚结构的保证。单细胞测序技术的发展,为研究心脏发育过程尤其是第二心区的发育,提供了一个强有力的手段。该研究组利用高精度的单细胞转录组测序技术,对小鼠胚胎心脏发育四个关键时期的心脏单细胞进行了系统的生物信息分析。该研究精确地识别了不同心区来源的干细胞,心肌细胞以及内皮细胞等主要的细胞类型,并在不同细胞类型之间进行了全面的配体-受体对分析,筛选出一对重要趋化因子——受体(MIF-CXCR2/4)。研究人员利用原代细胞和体外胚胎培养模型,以及基因敲除小鼠的体内模型,系统而全面地验证了MIF-CXCR2/4趋化作用能够介导第二心区的干细胞正常迁移到心管中,促进右心室等结构的发育。另外,研究还揭示了趋化因子受体CXCR2/4的时空表达受到心脏发育关键转录因子NKX2-5的直接调控。该研究提出了一种新的器官内不同部位互相通讯(intra-organ crosstalk)、互作协同发育的模型。
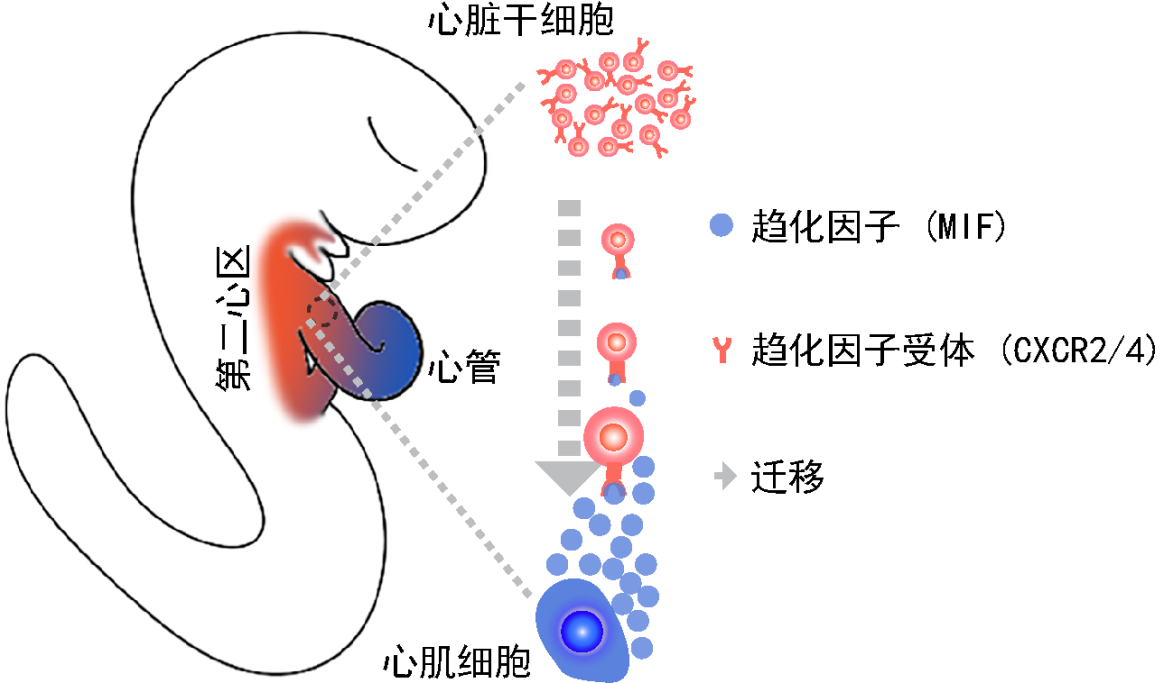
趋化信号调控第二心区干细胞迁移至心管发育的模式图
北京大学生命科学联合中心博士生熊海清、罗颖洁和北京大学分子医学研究所博士生岳晏竹、张婕婕为论文共同第一作者,何爱彬为本文的通讯作者。该研究获得了科技部干细胞专项、国家自然科学基金委的和生命科学联合中心的支持。
转载本网文章请注明出处