生命科学学院郑晓峰课题组在PNAS发文 揭示DNA损伤修复调控的新机制
2019/12/13 信息来源: 生命科学学院
编辑:山石 | 责编:白杨2019年12月3日,《美国科学院院报》(PNAS)在线发表了生命科学学院郑晓峰研究组的题为“Cellular redox sensor HSCARG negatively regulates the translesion synthesis pathway and exacerbates mammary tumorigenesis”的长篇研究文章。该研究发现细胞氧化还原状态感受器蛋白HSCARG通过抑制PCNA的泛素化修饰阻断跨损伤DNA合成(TLS),进而加剧乳腺癌的发生发展,揭示了跨损伤DNA合成通路调控的新机制。
在DNA复制过程中,PCNA蛋白围绕 DNA形成环状三聚体以增强DNA合成的持续性,当复制叉被DNA损伤位点阻挡时,PCNA蛋白的泛素化修饰启动跨损伤DNA合成途径,这一修复途径的激活帮助细胞规避更为严重的DNA双链断裂的产生。
郑晓峰课题组发表在PNAS的研究鉴定了一个新的PCNA相互作用蛋白HSCARG。HSCARG能够增强USP1/UAF1复合体对PCNA的去泛素化活性,并进一步导致TLS通路的失活,双链断裂的形成和突变的累积。生物信息学分析以及免疫组化和乳腺癌模型小鼠相关表型实验结果一致表明,HSCARG在乳腺癌组织中存在着高表达现象,敲除内源的HSCARG能够减缓乳腺癌的自发形成。HSCARG本身在胞内的调控功能又受到细胞氧化还原状态的影响,当细胞在氧化压力下,HSCARG由二聚体解离为单体,由细胞质进入细胞核,上述变化增强了HSCARG对TLS通路的调控效率。
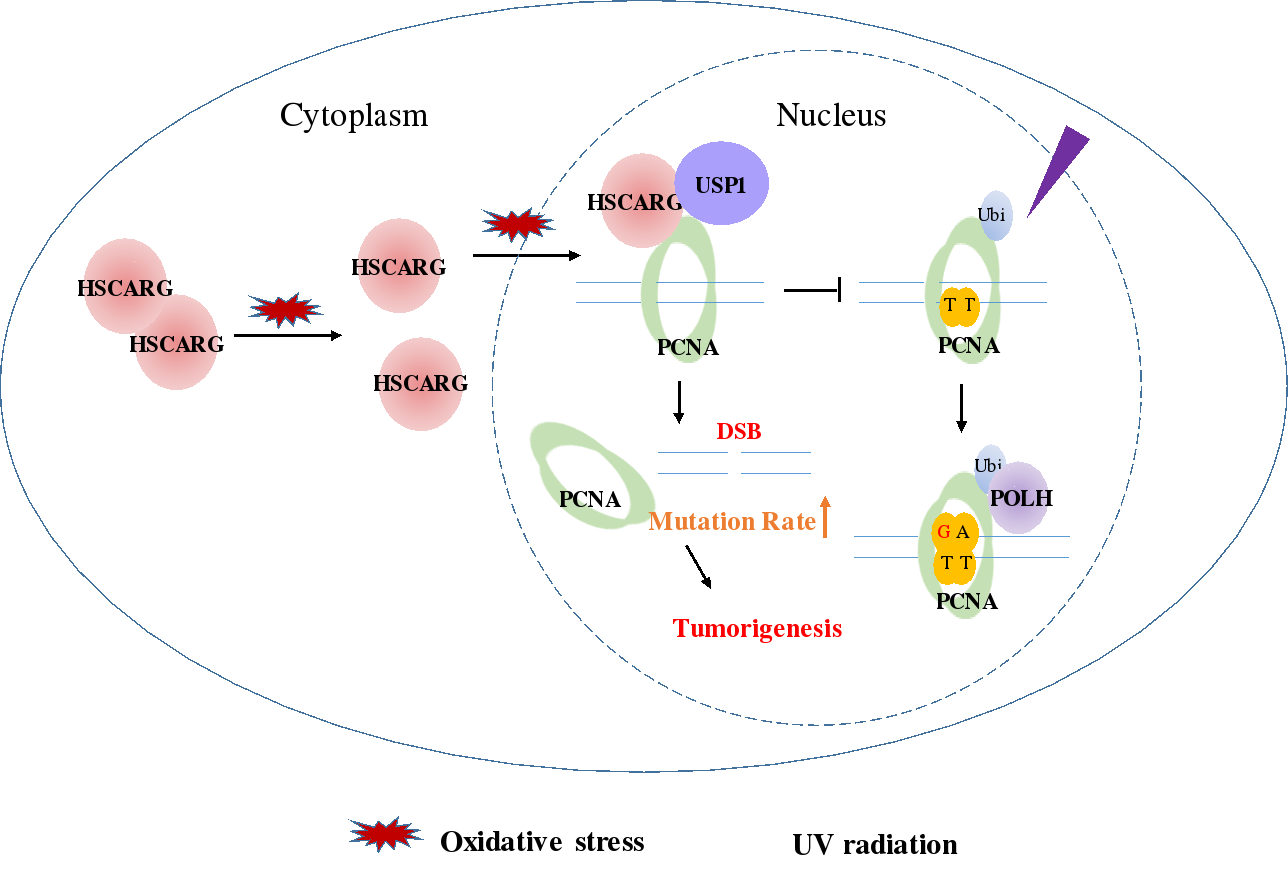
HSCARG调控跨损伤DNA合成应答模式图
以前的研究显示,HSCARG在胞质中抑制活性氧自由基(ROS)和一氧化氮(NO)的过度生成,这表明HSCARG兼具一定的抑癌功能。该研究发现HSCARG促癌和抑癌功能之间的平衡关系受到细胞氧化应激强度的精细调控。细胞在较弱的氧化刺激下,HSCARG由二聚体解聚为单体,有助于激活其本身在胞内的调控功能,但此时大部分的HSCARG仍然定位于胞质中,因而HSCARG主要发挥负调控ROS和NO过度产生的功能,帮助细胞回复到正常的氧化还原状态;而当细胞面临高强度的氧化压力时,大量HSCARG从细胞质迁移至细胞核中,使得其在细胞质中的功能被抑制,在细胞核中抑制TLS,激活细胞凋亡或癌变的功能。
综上所述,该研究揭示了跨损伤DNA合成途径更为精细的调控机制,并建立了细胞氧化还原状态和DNA损伤修复之间的联系。
北京大学郑晓峰课题组的博士研究生臧维成为PNAS论文第一作者,郑晓峰教授为文章的通讯作者。该研究得到了国家科技部重点研发计划、国家自然科学基金重点项目、蛋白质与植物基因研究国家重点实验室、生命科学学院以及生命科学学院仪器中心的大力支持。
转载本网文章请注明出处