运动医学所敖英芳课题组在《自然通讯》发表小分子化合物治疗骨关节炎新成果
2019/05/02 信息来源: 北医三院
文字:石媛媛 胡晓青| 编辑:白杨 |2019年4月23日,北京大学运动医学研究所敖英芳教授团队在 Nature 子刊——《自然通讯》( Nature Communications ,IF:12.353)上发表了题为“A small molecule promotes cartilage extracellular matrix generation and inhibits osteoarthritis development”(一种小分子化合物促进软骨细胞外基质生成及抑制骨关节炎的进展)的研究成果。

报道网页截屏
骨关节炎(osteoarthritis, OA)是一种以关节软骨退变、软骨下骨硬化、滑膜增生和骨赘形成为主要病理表现的退行性关节疾病,也是最常见的关节疾患和引起中老年人慢性残疾的首要因素。世界卫生组织调查结果表明,全世界有10%的人口患有不同程度的OA,并将OA与心血管疾病和肿瘤并列为影响人类健康的三大杀手。OA的高患病率和致残率使其成为影响人类健康的严重问题,也是运动医学与骨关节外科领域内国际性重大课题。
目前OA治疗方法多局限于对症治疗,即营养软骨、缓解疼痛、手术治疗等,而不是针对其发病机理与病理过程来延缓OA的进展。因此,我们迫切需要深入探索引起OA中关节软骨损伤的分子机制,找到并验证OA发生发展过程中的关键节点,为临床治疗OA提供新的理论依据及潜在靶点。软骨细胞外基质(extracellular matrix,ECM)渐进性降解和破坏是OA最重要的病理特征。结构完好的软骨组织ECM可有效分散运动过程中的软骨压力和剪切力。ECM由软骨组织内部唯一的细胞——软骨细胞合成,软骨细胞的合成代谢和分解代谢之间的动态平衡可以使软骨组织保持稳态。随着OA的发展,软骨细胞的增殖、分化异常,出现大量肥大软骨细胞,分泌较多ECM分解因子,加速ECM降解,导致软骨细胞凋亡,最终关节软骨破坏。因此探寻作用于软骨细胞合成代谢或者分解代谢的分子靶点,进而调控软骨ECM的合成,是有效延缓OA进程的关键。
与遗传学手段相比,小分子化合物具有其独特的优势,但小分子化合物在OA治疗方面的研究尚处于起步阶段,如能及时深入开展小分子化合物在OA方面的研究和应用,必将改变OA传统的治疗方法,延缓甚至逆转OA的疾病进程。
本研究利用蛋白多糖染色的方法,通过筛选2320种天然和合成小分子化合物库,成功筛选出一种新的DMOADs化合物—BNTA。
研究团队分别利用软骨细胞体外培养模型、软骨组织块离体培养模型和前交叉韧带切断诱导的大鼠OA动物模型,验证BNTA改善OA的实验效果。研究发现BNTA可以有效促进软骨细胞的合成代谢,增加软骨ECM相关标志物的表达。同时,实验观察到BNTA能够抑制软骨组织块和大鼠OA膝关节软骨组织的分解代谢和炎症反应,促进软骨细胞外基质的合成,改善大鼠膝关节的疼痛症状及软骨下骨的硬化程度,缓解甚至抑制OA进展。此外通过对大鼠膝关节软骨组织的转录组测序,研究团队初步锁定SOD3为BNTA的药物靶点。进一步通过RT-PCR、Western blotting、细胞免疫荧光、免疫组织化学、敲低或者过表达等分子生物学实验证实,BNTA通过上调超氧化酶歧化酶3(SOD3)的活性,催化超氧阴离子的歧化反应进而降低超氧阴离子的含量发挥保护软骨细胞以及抑制OA进展的生物学作用。
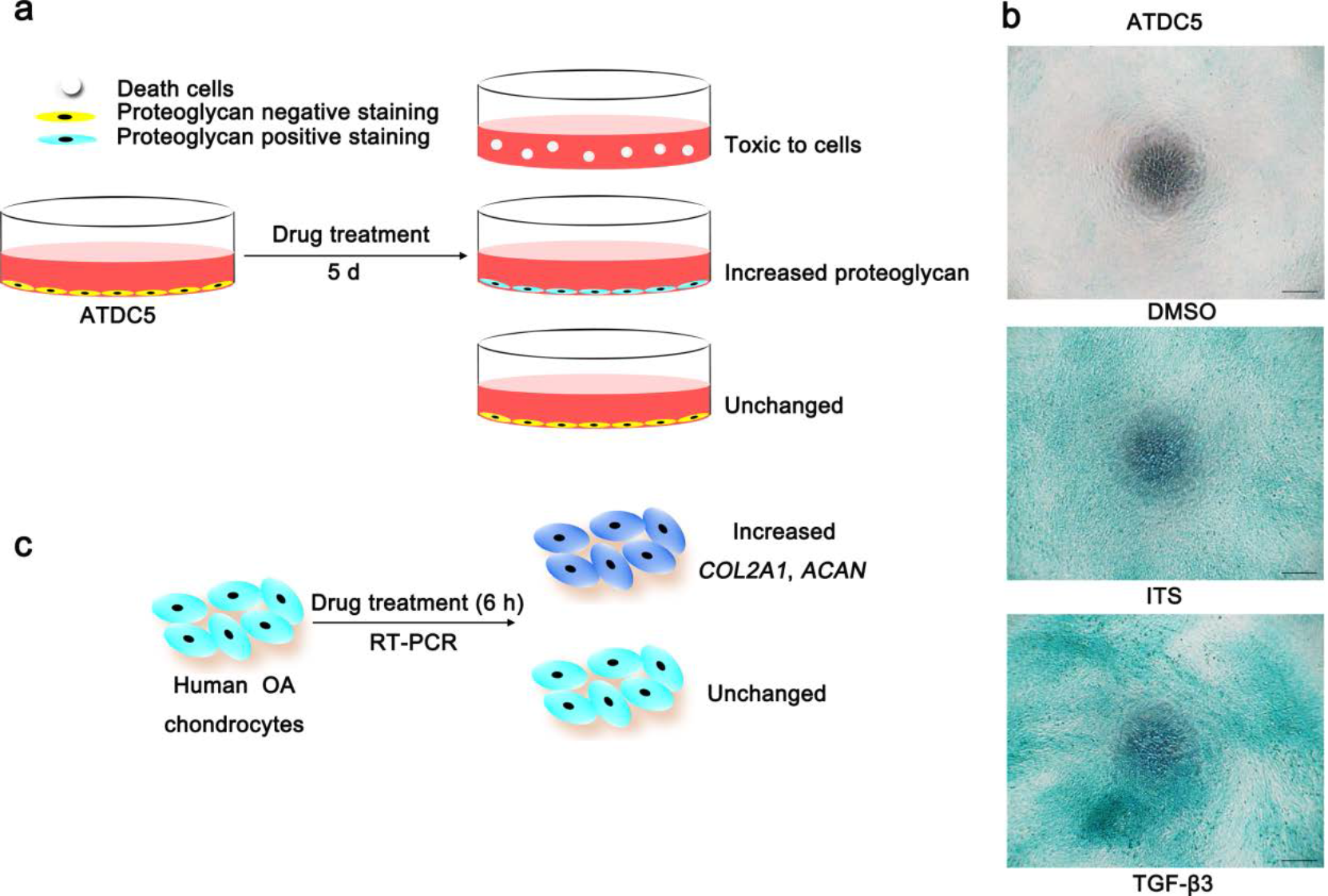
筛选DMOADs小分子化合物的示意图

大鼠OA膝关节腔内注射BNTA化合物4周后,膝关节的组织学染色结果和OARSI评分
由于小分子化合物BNTA具有结构稳定、易于保存、制备流程标准化等优势,因此BNTA在OA治疗方面具有非常乐观的应用前景。同时本研究为后续利用BNTA进行OA治疗方面的深入研究及其临床转化奠定了基础。
该研究由北京大学第三医院运动医学研究所敖英芳教授团队完成,敖英芳教授和王健全教授为该论文的共同通讯作者;运动医学研究所2016级博士研究生石媛媛和胡晓青副研究员为该论文的共同第一作者。
该论文是北京大学第三医院运动医学研究所团队继2019年4月初在Science Translational Medicine、2017年8月在Advanced Materials上发表重要成果之后的又一篇高水平文章。该研究所在1年8个月之内发表3篇国际高水平文章,表明研究所在注重研究成果与论文发表量的基础上,不断加强学术研究水平与提升论文质量。该研究得到国家自然科学基金和北京市自然科学基金等项目的资助。
转载本网文章请注明出处