分子所陈良怡、刘彦梅课题组揭示活体胰岛β细胞功能成熟机制
2019/02/27 信息来源: 分子医学研究所
编辑:麦洛 | 责编:白杨近日,北京大学分子医学研究所陈良怡研究员、刘彦梅副研究员课题组在国际知名学术期刊eLife发表题为“In Vivo Imaging of β-cell Function Reveals Glucose-mediated Heterogeneity of β-cell Functional Development”的研究论文,首次实现活体动物体内胰岛β细胞功能的实时成像,揭示胰岛通过血管化协调传递适宜浓度的葡萄糖至β细胞,进而激活calcineurin/NFAT信号通路,最终介导胰岛从外壳到核心依次发生的两波β细胞的功能获得过程。由于这项工作在相关领域内的独创性和重要性,内分泌学科顶级杂志Nature Reviews Endocrinology对其进行了亮点介绍,认为该工作是技术进步推动科学重要发现的典型例证。
胰岛β细胞在血糖调控与糖尿病的发病中起着重要作用,其数量和功能直接和血糖紊乱程度密切相关。近年来,基于干细胞的胰岛β细胞再生治疗糖尿病是领域内重要研究方向。但是,通过诱导干细胞分化为β细胞的方法目前仍然不能产生功能完全成熟的β细胞,最主要的原因是研究者尚不清楚在体内β细胞如何受其微环境包括血管、神经元和其它内分泌细胞等分泌的因子影响实现功能成熟。过去的研究方法,不论是基于免疫组化或是大规模测序的方法,得到的信息都局限于某几个时间点,同时也缺乏在体空间信息,不能展示β细胞在天然胰岛微环境中发育和获得功能的时空图谱,也限制了其在体功能成熟的机制研究。
2015年,陈良怡课题组与合作者研发成功基于新成像原理的超快双光子扫描光片显微镜(2P3A-DSLM)(Cell Res.2015,
doi:10.1038/cr.2014.124),成像质量显著优于单光子光片显微镜或双光子点扫描显微镜,在领域内引起高度反响,多次受邀在如国际激光及光电子大会以及国际光片显微镜大会上作特邀报告,成果发表于Nature
Methods光片显微镜权威综述认可(Nature Methods, 2019,
doi:10.1038/nmeth.4224)。利用2P3A-DSLM显微镜和自主创建的β细胞被红色荧光钙指示剂Rcamp1.07标记的转基因斑马鱼,陈良怡、刘彦梅课题组首次实现了活体观察每个β细胞在葡萄糖刺激下的钙反应,并发现β细胞功能成熟的从外到内的过程是由葡萄糖所控制。胰岛微循环精细控制递送到每个β细胞的局部葡萄糖浓度,而该浓度随着发育过程逐渐增加,并通过激活calcineurin/NFAT信号通路,精细地调控胚胎β细胞功能获得以及增强的过程。
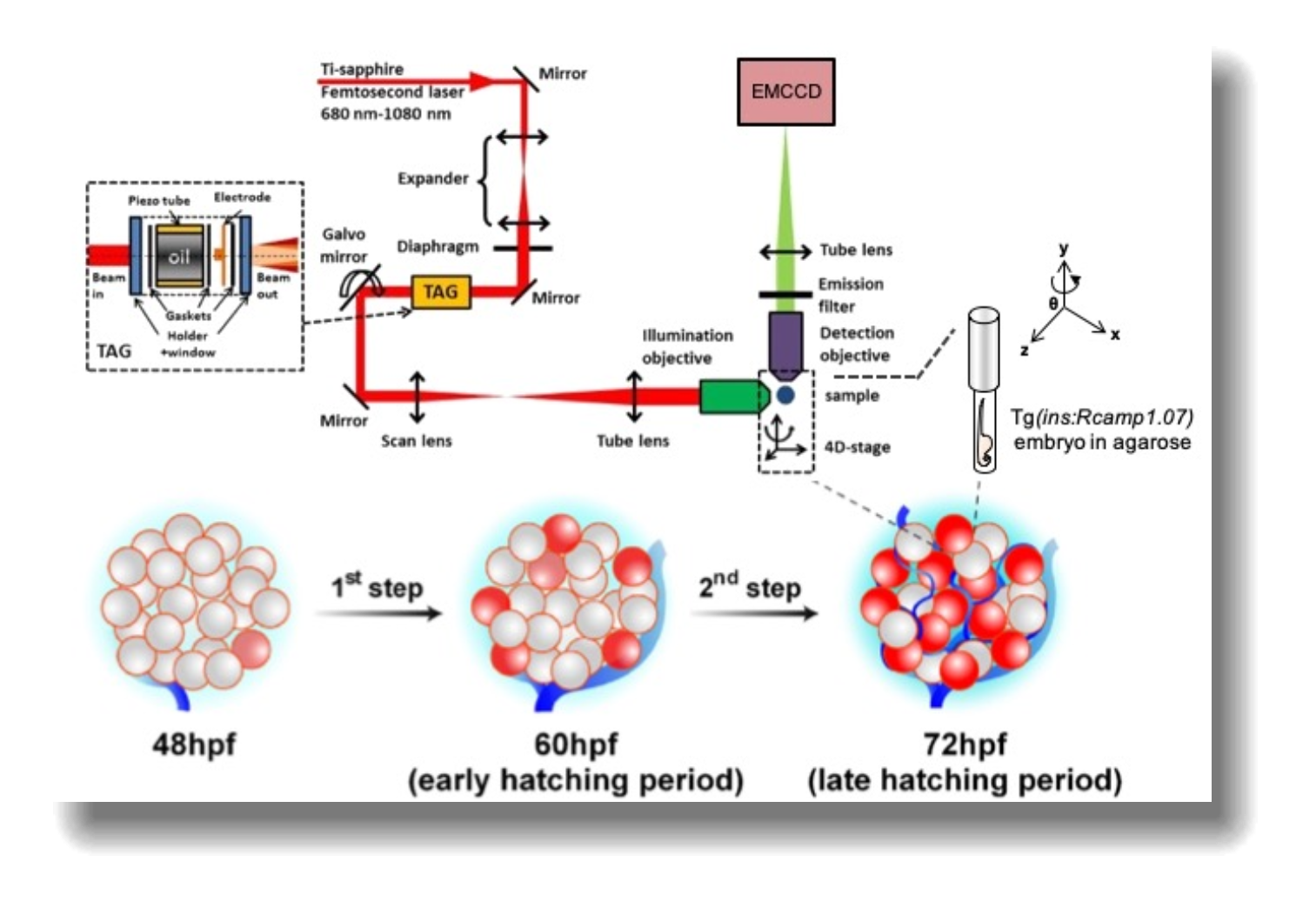
斑马鱼在体胰岛b细胞时空上异质的功能成熟过程。上图:双色双光子扫描光片显微镜原理图;下图:经历两个阶段,胰岛β细胞从外到内的逐渐功能成熟
他们进一步发现,calcineurin/NFAT通路也可以促进初生小鼠的胰岛离体成熟过程,证明此机制不仅仅适用于斑马鱼,也是哺乳动物中以往被忽略的、促使β细胞功能成熟的关键因子。Nature Reviews Endocrinology2月19日发表题为“Imaging β-cell function in vivo”的权威评论,认为“这项工作首次实现在动物活体可视化单个胰岛beta细胞的功能,同时揭示了重要的功能成熟过程。”eLife也以文摘的形式(题目为“Watching β-cells mature ”)特别展示这项工作,认为“斑马鱼的工作可以帮助研究者找到在体外制备、来源人多能干细胞的β细胞的更好方法,助力于糖尿病病人的再生医学治疗。”这种结合转基因斑马鱼和三维在体高分辨率显微成像平台,未来可用于研究胰岛生物学中包括转分化、去分化和糖尿病发病过程中的在体再生等重要过程及其机制。
北京大学分子医学研究所博士生赵佳为论文的第一作者,陈良怡、刘彦梅(现为华南师范大学脑科学与康复医学研究院研究员)为论文共同通讯作者。这项研究受到科技部重点研发计划、国家自然科学基金委重大研究计划,北京市自然科学基金等经费支持。
转载本网文章请注明出处