生命中心雷晓光、肖俊宇课题组与合作者在PNAS发文揭示治疗多发性骨髓瘤和三阴性乳腺癌的潜在药物靶点和候选药物分子
2019/12/04 信息来源: 北大-清华生命科学联合中心
编辑:麦洛 |多发性骨髓瘤(Multiple myeloma,MM)和三阴性乳腺癌(triple-negative breast cancer,TNBC)是两种截然不同的肿瘤类型,仅在美国,预计2018年两者合计新增病例超过7万例,并导致超过1.6万人死亡(American Cancer Society 2018 Facts and Figures)。MM起源于恶性浆细胞增殖,而TNBC则是一种由缺乏雌激素、孕酮和HER2受体导致的对大多数激素疗法具有耐药性的高度转移性乳腺癌。尽管MM和TNBC在生理表现或目前的药物干预方面没有明显的相似之处,但它们都依赖于26S蛋白酶体功能来维持正常的肿瘤生存。这一依赖性也成为了TNBC和MM的“阿喀琉斯之踵”。FDA已经批准bortezomib、carfilzomib和ixazomib等数个蛋白酶体抑制剂用于治疗MM,但这类药物的使用通常会导致癌症耐药性与复发,最终使治疗失败,因此亟需开发克服耐药的新的治疗方法。
26S蛋白酶体在其不同的亚基上有>300个保守的磷酸化位点,但参与相关修饰的激酶和磷酸酶还远未获得充分研究。美国UCSD的Jack E. Dixon教授课题组在之前的研究中发现,双特异性酪氨酸磷酸化调控激酶2(DYRK2)是一个蛋白酶体调控激酶(X. Guo et al., Nature Cell Biology 18, 202-212 (2016))。它磷酸化蛋白酶体RPT3亚基上的Thr25位点,增强蛋白酶体活性;抑制这一磷酸化过程则显著降低蛋白酶体活性,进而导致TNBC小鼠异种移植模型中肿瘤细胞周期进展受阻、生长减缓【S. Banerjee et al., PNAS115, 8155-8160 (2018)】。
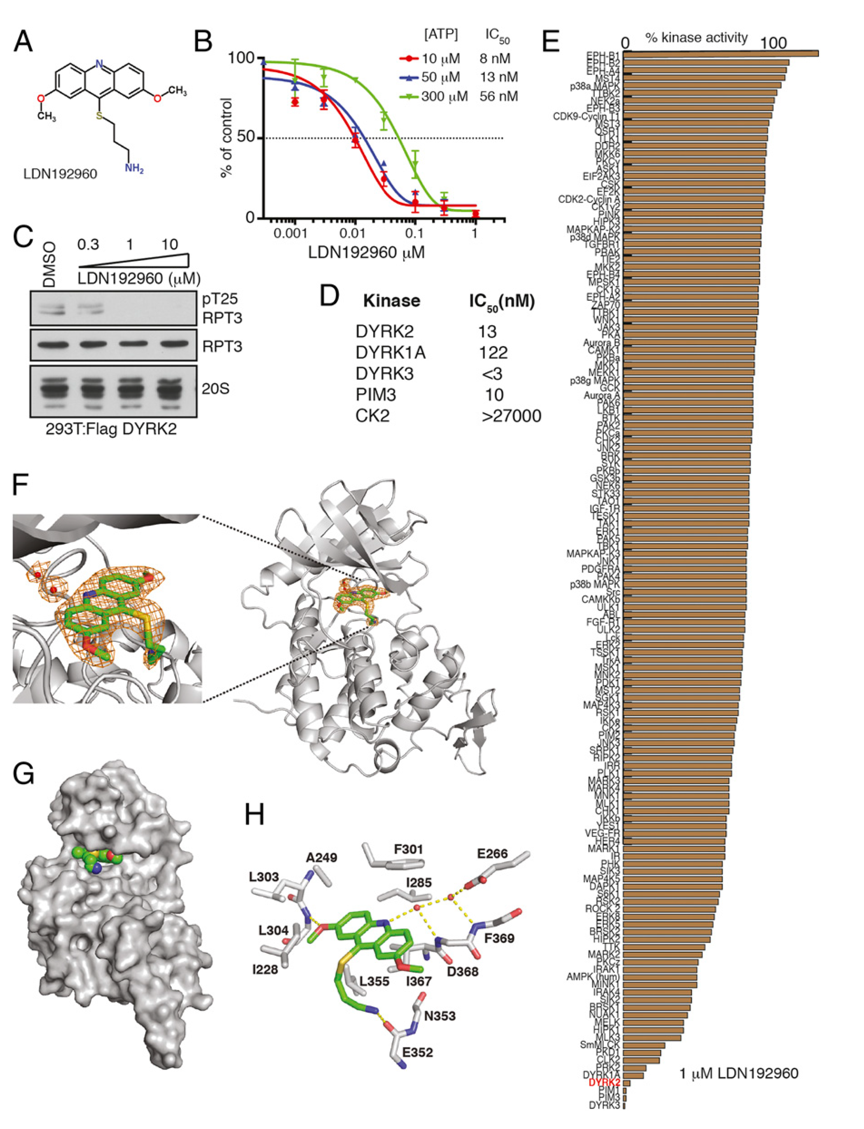
高活性、高选择性DYRK2小分子抑制剂
近日,PNAS在线发表了北大-清华生命科学联合中心、北京大学雷晓光教授、肖俊宇研究员与Dixon课题组的最新研究成果“Inhibition of Dual-Specificity Tyrosine-phosphorylation Regulated Kinase 2 Perturbs 26S Proteasome-addicted Neoplastic Progression”。这项工作验证了蛋白酶体调节因子DYRK2作为多发性骨髓瘤和三阴性乳腺癌的治疗靶标的可行性,并报道了一种高效、高选择性的DYRK2小分子抑制剂,在细胞与动物水平验证了该分子的抑癌作用。由于使用了抑制蛋白酶体调节因子这一新颖的机制,该小分子抑制剂可以克服多发性骨髓瘤和三阴性乳腺癌对蛋白酶体抑制剂产生的耐药性。该工作表明,靶向26S蛋白酶体调节因子有望成为针对多发性骨髓瘤和三阴性乳腺癌的新治疗策略,为克服肿瘤耐药性难题提供了新的思路。目前,雷晓光、肖俊宇课题组正在与北大人民医院路瑾医生团队紧密合作,进一步积极推进针对临床多药耐药的多发性骨髓瘤的转化医学研究与临床前候选药物开发。
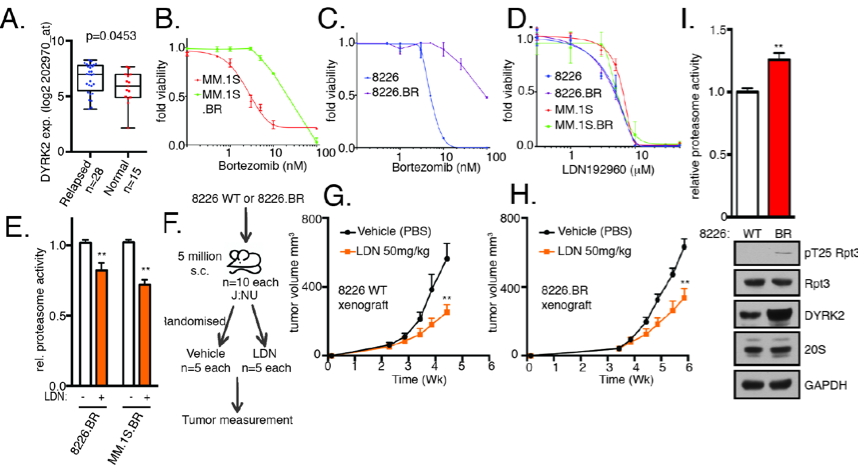
DYRK2小分子抑制剂可以克服多发性骨髓瘤临床耐药性
美国UCSD的Sourav Banerjee博士,北京大学博士生魏田田、王珏为该论文的并列第一作者,雷晓光、肖俊宇和Jack E. Dixon为文章的共同通讯作者。该工作主要得到国家科技部重点研发计划-蛋白质机器专项、国家自然科学基金委-“生物大分子动态修饰与化学干预”重大研究计划、北大-清华生命联合中心等科研基金的资助。
转载本网文章请注明出处