未来技术学院刘颖研究组揭示氨基酸调控mTORC1信号通路活性新机制
2022/02/04 信息来源: 未来技术学院
编辑:山石 | 责编:知远细胞需要精确感知外界营养物质含量以改变自身代谢进程,从而调整细胞生长状态[1]。mTORC1复合物作为关键的营养物质感受调节器,当营养物质充足时,mTORC1信号通路活化,促进合成代谢,而营养物质匮乏时,mTORC1被抑制,抑制合成代谢,进而减缓细胞生长[2]。氨基酸作为关键的蛋白质合成元件,一般认为能够通过结合直接的感受蛋白(氨基酸受体)被细胞感知,从而将信号传递给mTORC1。亮氨酸作为mTORC1激活所必须的氨基酸,其感知机制重要且复杂。除了新近报道的亮氨酸受体蛋白SAR1B[3],另一受体蛋白Sestrin2也在此前被报道对于mTORC1的活化至关重要[4-5],然而亮氨酸如何通过结合Sestrin2从而影响下游生物学进程却并不清楚。
2022年2月2日,北京大学未来技术学院分子医学研究所、北大-清华生命科学联合中心、北京未来基因诊断高精尖创新中心刘颖课题组在Molecular Cell杂志发表了题为“E3 ligase RNF167 and deubiquitinase STAMBPL1 modulate mTOR and cancer progression”的研究论文,报道了泛素连接酶RNF167和去泛素化酶STAMBPL1对mTORC1的调控机制及其重要的病理意义。
研究人员发现亮氨酸感受蛋白Sestrin2在缺乏氨基酸时,会发生K63类型的多聚泛素化修饰。通过进一步筛选,研究人员确定了泛素连接酶RNF167和去泛素化酶STAMBPL1参与调控Sestrin2泛素化修饰,而亮氨酸的结合与否直接决定Sestrin2与RNF167及STAMBPL1的结合程度,进而使Sestrin2能够发生响应于亮氨酸含量变化的泛素化修饰程度改变。Sestrin2泛素化修饰能够促进其与GATOR2复合物的结合,从而影响mTORC1活性。通过生物信息学分析和建立裸鼠皮下瘤模型,研究人员证明了该机制在结直肠癌发生发展过程中的重要作用。基于该机制,研究人员设计了多肽类药物,并初步展现了良好的抑癌效应,将来有望成为治疗结直肠癌的新方法(图1)。
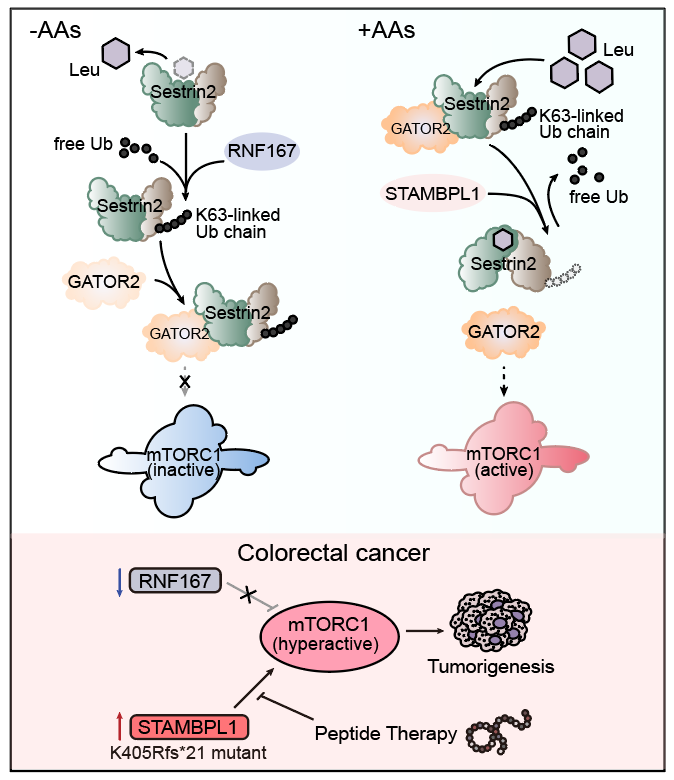
图1. RNF167和STAMBPL1调控mTORC1活性及肿瘤发生
北京大学刘颖教授为本文通讯作者,北京大学未来技术学院分子医学研究所博士研究生汪冬和徐晨晨为本研究共同第一作者,元培学院本科生杨文予、北京大学陈杰博士、欧宇辉博士、博士研究生管媛媛、关嘉良均对本工作作出重要贡献。
参考文献:
1. Kim, J. and K.L. Guan, mTOR as a central hub of nutrient signalling and cell growth. Nat Cell Biol, 2019. 21(1): p. 63-71.
2. Liu, G.Y. and D.M. Sabatini, mTOR at the nexus of nutrition, growth, ageing and disease. Nat Rev Mol Cell Biol, 2020. 21(4): p. 183-203.
3. Chen, J., et al., SAR1B senses leucine levels to regulate mTORC1 signalling. Nature, 2021. 596(7871): p. 281-284.
4. Wolfson, R.L., et al., Sestrin2 is a leucine sensor for the mTORC1 pathway. Science, 2016. 351(6268): p. 43-8.
5. Saxton, R.A., et al., Structural basis for leucine sensing by the Sestrin2-mTORC1 pathway. Science, 2016. 351(6268): p. 53-8.
转载本网文章请注明出处