生命科学学院蒋争凡课题组发现STING活化共配体
2021/05/02 信息来源: 生命科学学院
编辑:山石 |cGAS是胞质内双链DNA或Mn2+的受体,也是一个二核苷酸环化酶,被DNA和/或Mn2+激活后利用细胞质中的ATP和GTP合成第二信使2’3’-cGAMP,后者进一步激活STING,最终介导抗病毒/肿瘤免疫反应。而Mn2+激活的cGAS以一种更高效路径合成2’3’-cGAMP,Mn2+单独使用或与PD-1抗体联合使用(锰免疗法)可显著增强肿瘤治疗效果。cGAMP与STING结合后,STING需要从内质网转移到高尔基体才能够被活化。但为什么STING活化必需从内质网转位至高尔基体一直是领域内悬而未决的重要科学问题。

2021年4月14日,北京大学生命科学学院蒋争凡实验室在Immunity上以research article形式在线发表了STING为什么需要进行高尔基体转运的机制研究“Golgi-synthesized sulfated glycosaminoglycans mediate polymerization and activation of the cGAMP sensor STING”,报道高尔基体内合成的硫酸化糖胺聚糖(sGAGs)作为STING共配体介导STING在高尔基体的活化。在本研究中,蒋争凡实验室的方润博士和蒋启飞同学巧妙地利用了STING自激活突变体诱导细胞死亡的特性,进行了基于CRISPR–Cas9介导的全基因组筛选,发现多个参与硫sGAGs合成的关键基因被高度富集(图1)。这些sGAGs合成关键基因的敲除使细胞丧失了对STING的反应性。随后,他们通过构建基因敲除细胞,证明高尔基体内sGAGs缺失严重削弱cGAS-STING通路的激活。STING和sGAGs核心蛋白SRGN存在DNA病毒诱导的共定位和相互作用。体外实验表明STING和肝素存在直接的相互作用,cGAMP促进STING肝素结合。位于STING第一和第二跨膜区间的三个正电氨基酸残基参与结合硫酸化糖胺聚糖;而回复三个正电氨基酸中的任意一个都可使完全没有活性的突变体恢复部分功能。将它们突变为电性更强的氨基酸则更强激活STING。各种STING突变体与SRGN的相互作用强度和这些突变体的活性有非常一致的相关性;引入额外带正电的精氨酸则会使STING组成性地结合sGAGs而发生自激活(图2)。这些结果表明sGAGs和STING的结合能力是决定STING能否激活及激活强度的决定因素之一。
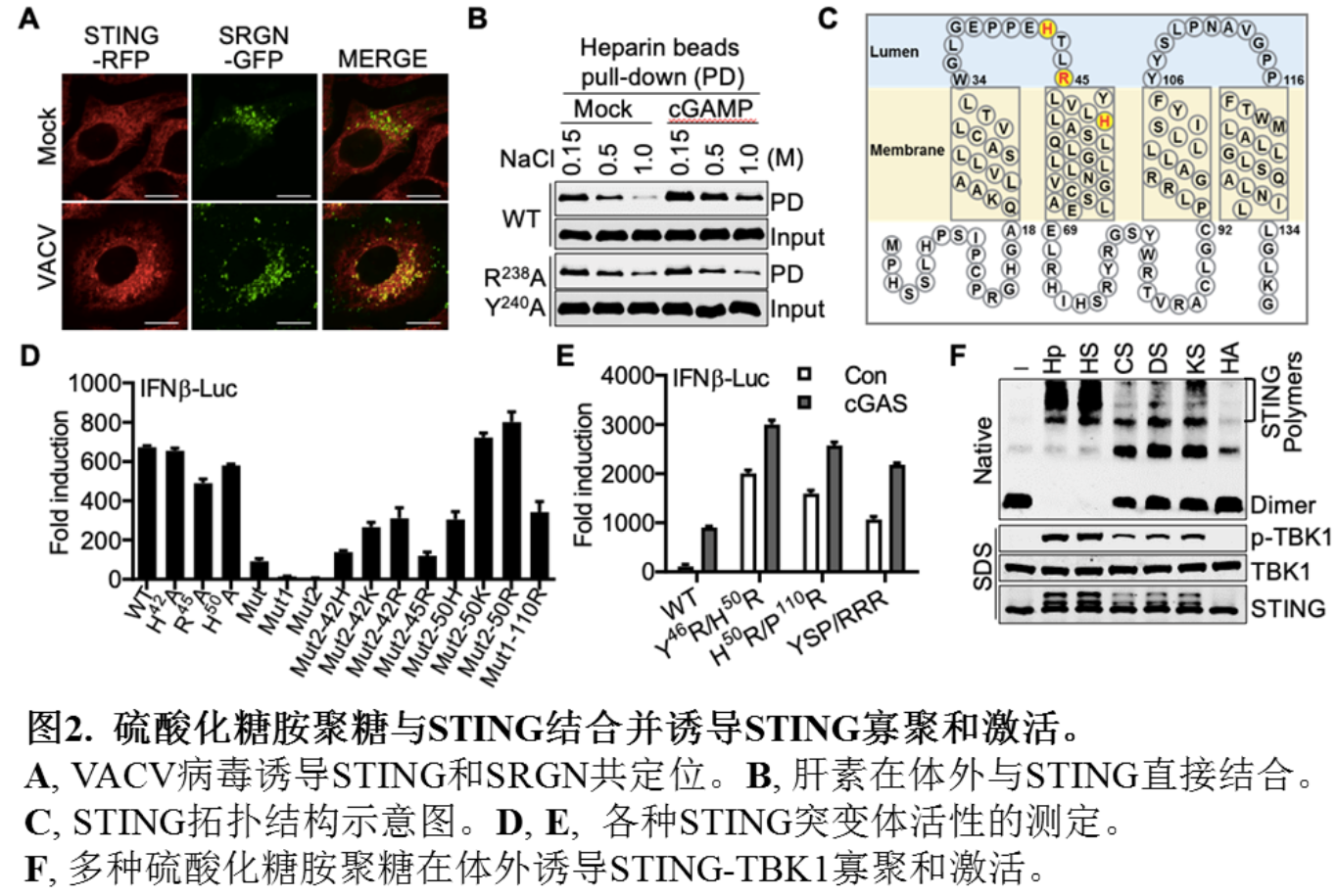
在体外,多种sGAGs可诱导STING全长蛋白发生多聚体化并诱导激酶TBK1的活化,其中硫酸肝素(HS)和肝素(Hp)的激活效果最佳(图2)。硫酸化糖胺聚糖激活STING是糖链长度依赖的,最短由四个单糖形成的糖链即具有激活STING的能力,并且这种激活依赖于糖链上的O-位硫酸化修饰。更为重要的是,sGAGs介导STING激活的机制在进化上高度保守。小鼠实验表明sGAGs的合成对于抵抗DNA病毒感染十分关键。
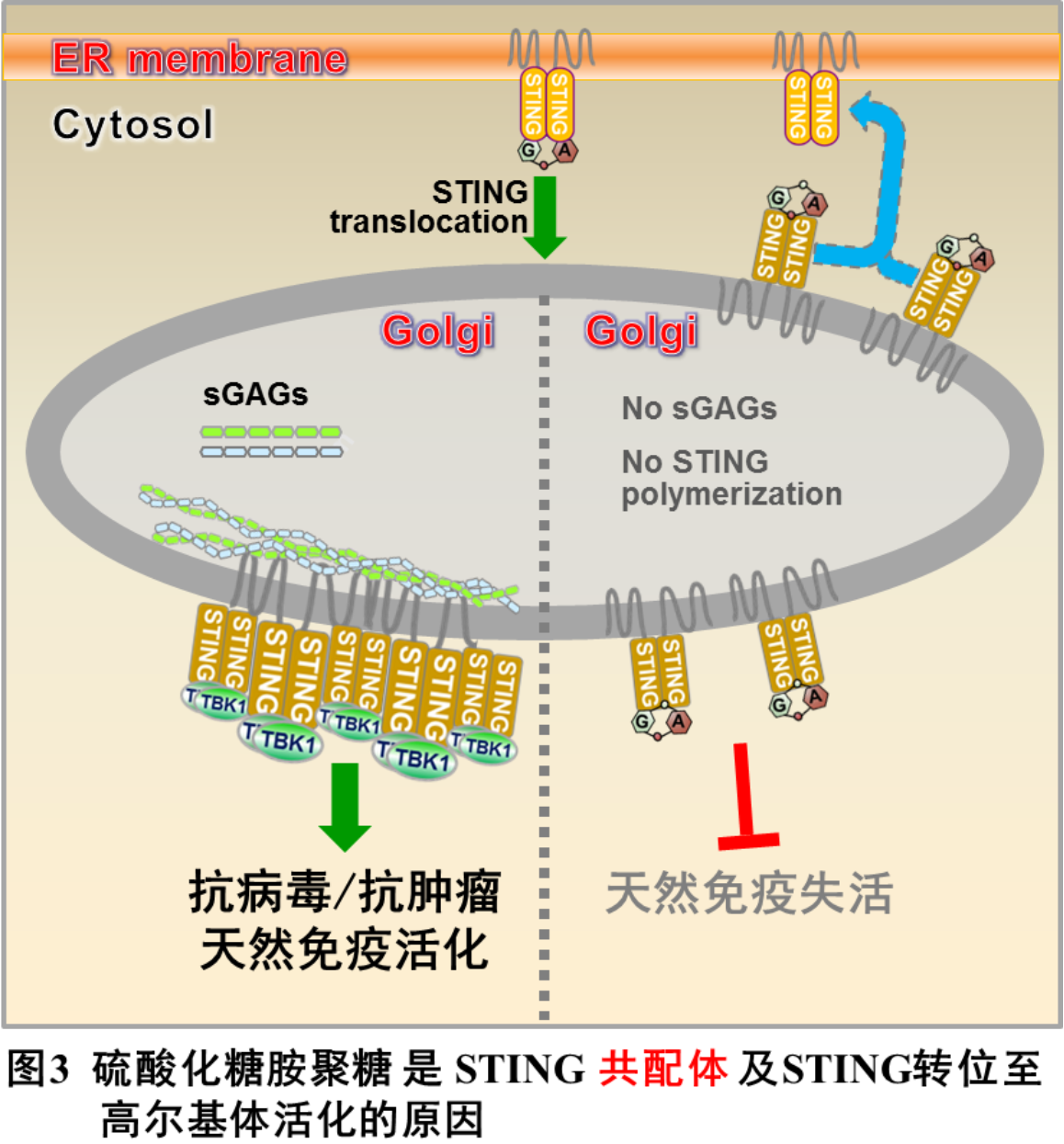
该研究发现STING活化需要二类配体。第一类配体是环化二核苷酸,与STING细胞质一侧的环化二核苷酸结合区域结合并导致STING转位至高尔基体;第二类配体是sGAGs,与STING高尔基体内一侧的正电荷(极性)氨基酸结合,像铰链一样引发STING的多聚化,进而招募并促进TBK1的自磷酸化及下游通路活化(图3)。该发现也揭开了“为什么STING必需去高尔基体活化”这一重要的谜题,有望打通STING活化的“最后一公里”。此外,该研究还填补了胞内硫酸化糖胺聚糖的生理学功能研究空白,揭示了生物多糖在细胞内的关键免疫学功能,为未来生物多糖在抗病毒、抗肿瘤的临床实践提供新的线索。
北京大学生命科学学院博士后方润和2015级博士生蒋启飞为该文章的共同第一作者,生命科学学院/北大-清华生命科学联合中心的蒋争凡教授为通讯作者。本研究工作得到了国家自然科学基金委、科技部国家重点基础研究项目、北京大学“细胞增殖与分化”教育部重点实验室及“北大-清华生命科学联合中心”的资助。
转载本网文章请注明出处