打通精准医学的“最后一公里”——北大工学院席建忠课题组发现微肿瘤形成新机制纪实
2020/06/25 信息来源: 新闻中心
文字:校报记者 陈振云| 编辑:山石 |北京时间2020年6月25日凌晨3时,北京大学工学院席建忠课题组联合北大肿瘤医院、人民医院等团队,在Science Translational Medicine杂志上发表以“Patient-Derived Tumor-Like Cell Clusters for Drug Testing in Cancer Therapy”(《患者来源类似肿瘤的细胞球可用于癌症治疗时的药效测试》)为题的文章,宣告发现了一种全新的原代肿瘤细胞自组装形成微肿瘤的新机制,建立了胃、肠、乳腺等癌种的微肿瘤模型。临床实验结果表明,微肿瘤模型预测患者治疗药效的准确性高达93%以上。这标志着席建忠教授团队多年来致力于打通精准医疗“最后一公里”的持续科研攻关有了关键突破。Science Translational Medicine杂志为文章配发了题为《小小细胞球大有前景》的“编者按”,按语指出,原代肿瘤细胞自组装形成微肿瘤的新机制旨在通过对肿瘤细胞及其基质细胞进行离体培养来克服目前为癌症患者制定精准诊疗方案中存在的缺点。该方法在应用于多种肿瘤类型患者的初步测试中已显示出令人鼓舞的结果。

席建忠
认准目标,持续关注“痛点”
“近年来,各种组学技术在精准医疗中得到了广泛的应用,但其临床应用潜力和效果一直受到一定的限制:很大比例的癌症患者没有可用药的突变基因;即使是有目标基因改变的患者,也由于比例范围较大、组成复杂等原因而缺乏有效指导临床方案的实用模型。”从2014年开始,席建忠教授带领团队持续关注肿瘤精准医学的“痛点”——发展一项能及时、直接、准确地反映患者药物敏感的辅助治疗技术。“过去的60年里,先后有上百种的肿瘤药敏检测模型或方法被报道,其中,比较有影响的有类器官(Patient-Derived Organoids,PDO)、患者来源的肿瘤异种移植模型等,但这些技术在检测周期、准确率、检测药物通量、检测成本等方面有局限性,因此指导临床用药的前景并不清晰。”席建忠介绍,体外模拟再现患者肿瘤的特征,特别是药物效果特征,成为国内外一个古老而又热门的研究课题。“说它古老,是因为从现代细胞生物学开始之时,无数工程师和科学家就致力于研发各种各样的方法培养肿瘤细胞,毕竟这些是新药研发的基础。”持续关注研究痛点的席建忠也感受到了这一课题的“热度”:“说它热门是因为近十年,这一方向的研究投入更多,受到的关注也更大;不断有大量的新技术涌现,其中最有名的是荷兰科学家汉斯·克里夫(Hans Clevers)2009年发明的类器官技术,Nature Methods(《自然方法》)将类器官推选为2017年生命科学领域的年度技术。”席建忠说:“虽然这个研究方向已有半个多世纪的历史,但遗憾的是,目前在临床上还没有一个可以成功应用的方法。”2005年,席建忠在美国获得生物医学工程专业博士学位后,回到北大成为工学院生物医学工程系特聘学者,从此开始了对这一问题的持续关注。“研究的想法由来已久,这是生命科学、临床医学和药物研发等领域无数科学家和科研工作者的梦想。而真正投入大量精力开始专注于这一领域的研究,是从2014年开始。”从那时起,席建忠带领团队紧紧盯住打通技术通往临床应用的“最后一公里”目标,在这个领域不断摸索。
坚持不懈,攻克重重“难点”
精准医学“最后一公里”在于临床,席建忠团队正是以临床问题为抓手、医工结合新诊疗为途径,将科研的重心落在切实解决备受关注的肿瘤诊疗问题。“期间经历了各种各样的困难,但患者和家属期待的眼神是我们最大的动力,我经常告诉自己和团队要坚持下去,做真正对患者有用的科学技术。”
科研的最终目标是解决临床问题,所以在技术研发时,席建忠将医生视为非常重要的合作伙伴。“在整个团队的研究工作中,医生扮演三个关键角色。一是所有临床试验的参与者,他们负责提供所有的样本、收集临床数据等;二是实验是否成功的判断者,我们实验结果的好坏、标准能否应用于临床,医生是有话语权的,医生的反馈是我们研究判断的核心依据;三是在技术推广应用时,医生还是技术的实际使用者。”
席建忠没有想到,科研攻关过程中一大难点就是“等待医生、懂得医生”。面对医生的 “不守时”,席建忠其实非常理解:“中国的医生们是一群工作极其辛苦的团体,就算是约好时间,也经常因为医生在做手术而要等他们2-3个小时。”“夫君子之所以取者远,则必有所待”,“上门拜访”“等待医生”就成了席建忠团队的“必修课”。席建忠说:“科研攻关必须坚持开放的合作心态,我这几年访问过、面对面交流过的医生至少有800多位,现在一起合作的医生也不少于200位。坚持学习对方的专业知识、换位思考,得到合作伙伴——医生的认可和支持至关重要。在和医生沟通交流的过程中,我学会了简单地看PET、CT 影像图,学习了大量的医学专业知识。这样你才能从和医生的交流中准确把握关键信息,才能及时准确地制定研究方案。”
研究开始后,交叉学科专业性强导致团队间沟通困难的问题开始凸显出来。“大家关心的维度不一样。”谈到最关键的困难,席建忠说:“最主要的困难就是刚开始不知道前进方向,或者说真正的问题是什么。”席建忠带领团队沉下心来做研究,在六年的持续科研过程中经历了三个关键阶段。
“第一个阶段是在研究的初期,我们只有一个大概朦胧的目标,希望在这方面做一些探索。”席建忠介绍:“第二个阶段是研究开始进入真正有实质性进展并突破关键性技术难题的时期。”席建忠团队在和医生合作的过程中,经过反复探讨和不断的思维碰撞,逐渐意识到问题所在。“我们紧扣精准医学临床转化的本质,即一切以临床数据为最高检验标准,一切以满足临床需要为第一要务。这个阶段我们花了两年多的时间,将临床需求和技术反复碰撞对接,才认识到问题的关键是什么,在2016年年底,逐渐从数十个参数中凝练出三个最为关键的要素:第一是准确性,第二是时间窗口,第三是标准化。临床转化应用首要的就是准确,其次要切合临床的时间需求,最后就是技术一定可标准化,这是大规模推广应用的基础。”席建忠说:“目前研究已经到了第三阶段,对绝大部分肿瘤包括胃癌、乳腺癌、肺癌、肠癌等,我们的技术已经比较成熟,具备大规模临床试验和推广应用的基础。未来1-2年,我们将在相关政策的指导下,开始医疗器械注册证的申报等工作。”他特别指出:“对于胶质瘤、肝癌等其他一些癌种,我们现在还处于第二阶段。”
在重重“难点”被攻克后,席建忠教授团队历经六年锲而不舍的科研攻关,最终研发出微肿瘤PTC药敏检测模型。“我们为肿瘤患者在体外培养出成千上万个‘替身’来做药物测试。我们提供的是实实在在的测试结果。”不同于传统的类器官等培养技术,微肿瘤PTC药敏检测模型在检测周期、准确性以及临床转化应用等方面取得了机制和技术上的重大突破进展,有望在2到3年间得到大规模推广应用。
回首六年科研攻关路,席建忠欣慰地说:“让我觉得特别幸运的是,有一支执行力非常强的团队。”课题组会聚了“四大团队”:一是医生团队,包括来自北大肿瘤医院、北大人民医院、协和医院、301医院、上海胸科医院、华西医院等十多家医院的外科、内科、病理检测、影像等不同专业的医疗专家;二是北大数学学院的席瑞斌教授团队,在大规模测序、数据分析方面,提供强有力的技术支撑;三是合作的相关企业,在资金、产业转化等方面给予大力支持;四是来自北大的科研助手和学生团队,他们在六年时间里逐渐成长为课题研究的中坚力量。
对于这次取得的成果,席建忠一再强调团队的力量和作用:“这项研究是由北京大学工学院、北大肿瘤医院、人民医院以及北京基石生命科技有限公司等共同合作完成,尹申意博士、席瑞斌教授、武爱文主任、王殊主任是论文的并列第一作者,我和季加孚教授是论文的共同通讯作者。该工作得到了科技部、国家自然科学基金委等的支持。”
锐意创新,突破应用“堵点”
打通精准医学的“最后一公里”,关键在于创新技术的临床应用。
“研究团队发展了原代细胞自组装形成微肿瘤的新方法。通过改良培养基和培养微环境,优化了微肿瘤培养条件。”席建忠介绍,一方面,利用转录组测序、GO以及KEGG等技术,分析培养细胞与体内肿瘤组织间的信号通路差异,筛选各种信号通路调控因子以及小分子抑制剂,增加微球培养的成功率;另一方面,测试了一系列培养器件的基底亲憎水等性质对培养的影响,发展了微型高通量培养和筛选芯片。在此基础上,团队对209例新鲜胃癌和结直肠癌肿瘤样本进行消化解离培养,微肿瘤模型PTC的整体培养成功率为89.9 %(188/209,不包含感染和坏死样本)。对于PDOs不能或较难培养的瘤种或样本,如中低分化腺癌、神经内分泌瘤、粘液腺癌以及转移灶,微肿瘤模型PTC同样可以培养成功。
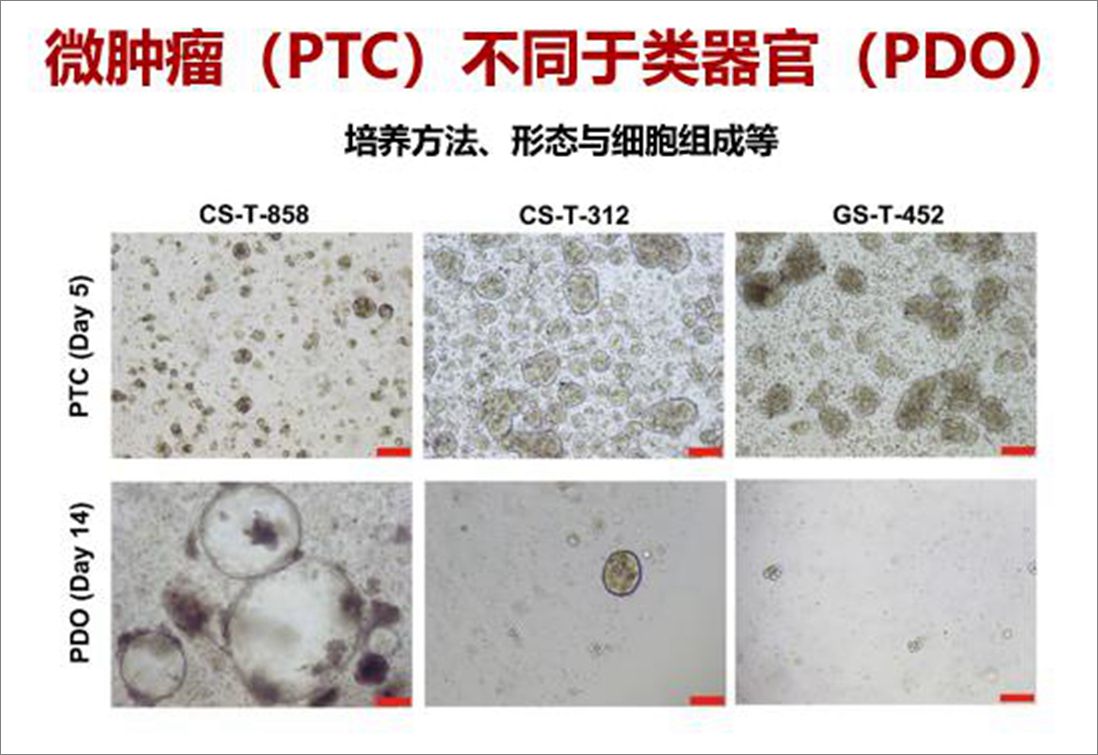
微肿瘤PTC的培养方法、形态与细胞组成
“微肿瘤PTC在培养时间、细胞组成等方面,具有明显的优势。”席建忠向记者介绍这一创新技术的优势所在:“无论是手术样本,还是内窥镜获得的样本,2周之内可以检测100-2000种药物;此外,微肿瘤PTC是由肿瘤干细胞、上皮细胞、成纤维细胞、巨噬细胞等多种细胞组成,能够很好地再现肿瘤组织本身的多细胞微环境与肿瘤上皮细胞的相互作用。”席建忠团队通过免疫荧光、流式细胞分析、转录组测序等大量方法分析,表明微肿瘤PTC与肿瘤组织在分子、细胞以及组织结构等方面,具有高度的一致性。
“最重要的是,团队采用微肿瘤PTC药敏检测模型进行了临床双盲验证。”席建忠强调这一步至关重要,“没有临床验证,前述的细胞培养和表征意义就大打折扣”。在入组并获得PTC的24位胃肠肿瘤患者和35位乳腺癌患者中,采用影像学结合Miller & Payne分级系统评估临床疗效,PTC检测结果与临床疗效的一致率达到93.6%。“一位56岁、预后差、常规用药方案少的男性粘液腺癌患者,在常规用药(XELOX方案)耐药后,利用微肿瘤PTC药敏检测技术,实现了跨适应症动态治疗;服用乳腺癌药物三个周期后,患者腹膜转移灶消失,腹水减少,肿瘤标志物下降,网膜结节减小,药效显著。”席建忠说:“这些结果表明PTC模型同样可以准确预测肿瘤患者对药物敏感的动态情况,对于复杂难治、恶性程度高的肿瘤,PTC可以充分发挥高通量等优势,帮助患者筛选跨适应症治疗方案,寻找更多可能的治疗机会。”

临床应用案例:粘液性肠癌患者跨癌肿动态治疗
PTC药敏检测技术如何打通肿瘤患者个体化治疗的“堵点”?席建忠介绍:“PTC药敏检测技术是近年来肿瘤诊治方法的重要的技术创新,克服了其他药敏检测技术的局限性,已成功应用于胃癌、肠癌、乳腺癌等患者的药物疗效预测中,可在临床决策中准确、前瞻性地指导肿瘤患者的个体化治疗,不仅使患者获益,延长生命周期,而且可以节省国家宝贵的医疗资源。此外,作为一种较有前景的肿瘤研究模型,PTC平台可有力地推动肿瘤临床医学在机制探索、新药开发、临床辅助诊断等领域的研究。”
着眼未来,开拓研究“重点”
“目前我们正处在全球生物医学快速发展的浪潮中,在浪潮下冲浪非常有压力,速度、方向和节奏等都非常重要。”人才是第一资源,近年来,席建忠非常注重面向全球生物医学发展的前沿,在科研攻关的过程中培养学生的责任感、领导力、配合度和换位思考的能力。庚子年初以来的新冠肺炎疫情给科研工作带来一定影响。在特殊的疫情时期,席建忠带领团队在保证安全健康的前提下,尽可能地持续开展科研攻关。“在重点研发计划等课题的支撑下,研究助手、博士后和部分学生按照学校相关规定的要求,回到学校开展实验攻坚。”席建忠经常和学生们交心:“国家和学校为我们创造了非常好的科研环境,我们应当为社会贡献自己的力量。”他还以身作则,告诉学生“领头羊”的真正内涵。“不是简单命令别人做什么,而是要让大家彼此信任、配合、协作,保证课题顺利进行。”
“我们的新技术平台刚完成第一步,就是证明精准医学、个体化用药这条路是走得通的,下一步可做的研究很多。”着眼未来,席建忠已经瞄准了《“健康中国2030”规划纲要》的蓝图,致力于开拓三个方向的研究重点:“一是推进新技术在精准医学、临床转化方面的应用;二是在基础研究方面与国内诸多顶级科学家开展合作,把新技术平台用好;三是积极拓展新技术在新药研发方面的应用,我们已经开始和一些药学研究专家和制药企业对接,促进新药研发。”
转载本网文章请注明出处