分子所汪阳明研究组发明控制基因编辑体系的新技术
2019/02/27 信息来源: 分子医学所
编辑:白杨 | 责编:麦洛北京大学分子医学研究所汪阳明研究组最近开发了一种由微小核糖核酸(miRNA)控制CRISPR开启的技术平台,开发出了在活细胞中监测miRNA活性的传感器,成功实现了CRISPR基因编辑体系的细胞特异调控。该项成果2019年2月25日在线发表于《自然-细胞生物学》,论文题目为“A microRNA-inducible CRISPR-Cas9 platform serves as microRNA sensors and cell type specific genome regulation tools”。
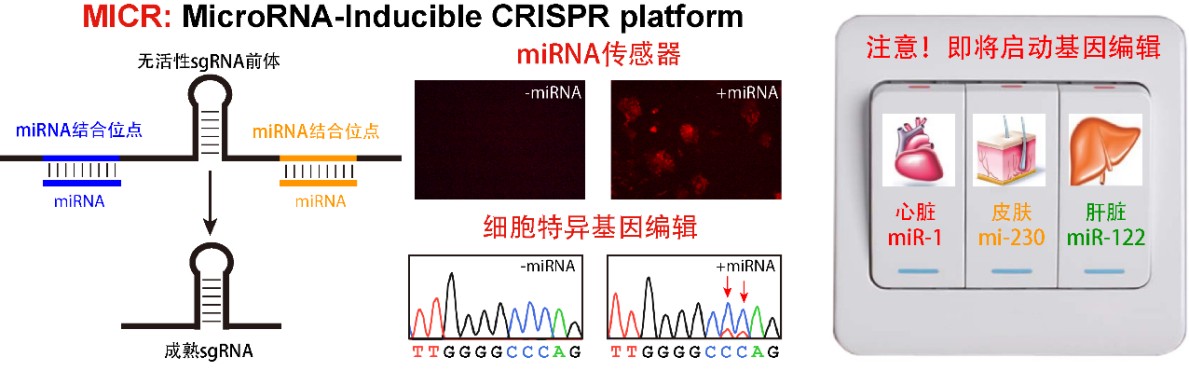
MICR: miRNA诱导启动的CRISPR基因编辑平台
miRNA是一类长度约22个碱基的核糖核酸分子,广泛表达于植物、动物以及病毒中。其表达谱呈现细胞特异性,即特定细胞一般会高表达某一个或几个miRNA,例如,心脏细胞高表达miR-1,而肝脏细胞高表达miR-122,不同的癌症组织也会表达不同的miRNA。因此,特定miRNA的表达可以用作指征细胞发育或疾病状态的标志物。然而,由于miRNA一般抑制基因的表达,迄今尚未有直接、灵敏且具备正向反应miRNA活性的生物传感器。
来自于微生物的II型规律成簇短回文重复序列系统(Type II CRISPR)自从2012年被改造为基因编辑工具后,带来了生物学研究、疾病治疗以及农作物育种等方面的一系列革命性进展,并有望在未来持续改变世界。然而,难以实现特异细胞的精准调控限制了CRISPR基因编辑体系的应用。
有意思的是,当研究人员将miRNA传感器和精准控制CRISPR体系结合在一起考虑的时候,上述两个问题都迎刃而解。汪阳明研究组发明的miRNA诱导启动的CRISPR基因编辑平台(MICR,miRNA-inducible CRISPR-Cas9 platform),简单地说,就是给基因编辑平台安上了一个开关,这个开关只有特定miRNA才能打开,因此可以只在特定的细胞或组织中开启基因编辑,而不影响其他组织和细胞。CRISPR基因编辑体系分为两个部分,一个由蛋白质(Cas9或者Cas9突变体融合蛋白)组成,执行基因编辑或控制基因表达的任务;另一个是sgRNA,介导Cas9蛋白质在基因组特定位置的结合。研究人员通过设计具有miRNA结合位点的没有活性的sgRNA前体,使得只有在特定miRNA表达的细胞中,才会通过miRNA介导的切割反应产生成熟的sgRNA,继而引导CRISPR基因编辑体系(包括碱基编辑、激活或者抑制特定基因表达)启动工作。这一改造实现了对CRISPR基因编辑系统的精准控制,有望增强其在疾病治疗过程中的安全性和有效性。
在该研究中,通过将MICR与荧光蛋白表达相偶联,研究人员成功实现了活细胞水平miRNA活性的可视化监测,并用以指征干细胞的分化状态。由于sgRNA的数目不受限制,因此该平台可以感知多个miRNA并对不同基因位点进行精准调控。作为这一概念的佐证,研究人员成功实现了在同一细胞中感知两种miRNA分别开启绿色或红色荧光蛋白表达,并进行了简单的“或门”计算。另外,利用MICR报告基因平台,研究人员首次在胚胎干细胞中发现了miRNA活性呈现不均一调控的异质性现象,且该异质性与干细胞发育和分化相关基因的表达水平显著关联。MICR平台有望广泛应用于动植物及病毒相关系统的研究,成为揭示生物学新现象、新规律和新机制的利器。此外,MICR也将为合成生物学、基于基因编辑体系的基因治疗提供新的技术手段和思路。
北京大学分子医学研究所2013级博士生王茜雯和胡鲁峰为该论文共同第一作者,博士生郝菁、廖乐祺、邱雅姿和实验技术员石铭参与工作。该研究由国家自然科学基金委和国家重点研发计划“干细胞与转化研究”试点专项资助,相关发明申请两项专利。
转载本网文章请注明出处