分子医学研究所张岩和肖瑞平团队发现心脏DNA损伤和心力衰竭新机制
2019/09/03 信息来源: 分子医学研究所
编辑:麦洛 | 责编:白杨9月3日,国际知名学术期刊Nature Cell Biology以长文形式在线发表北京大学分子医学研究所张岩副研究员、肖瑞平教授团队题为“CaMKII-δ9 promotes cardiomyopathy through disrupting UBE2T-dependent DNA repair”的研究成果。该研究发现,人类心脏中最主要的钙/钙调素依赖的蛋白激酶II(Ca2+/calmodulin protein kinase II, CaMKII)亚型CaMKII-d9通过损害范可尼贫血(Fanconi anemia,FA)通路依赖的DNA修复机制,导致心肌细胞DNA损伤聚集和基因组不稳定,进而引起心肌细胞死亡及后续的心力衰竭等心血管疾病。
成年哺乳动物的心肌细胞是终末分化细胞,增殖能力非常有限。很多外界刺激以及细胞内代谢产物等都会引起心肌细胞DNA损伤。如果损伤的DNA不能得到有效修复,会引起DNA的损伤积累和基因组稳定性下降,进而造成心肌细胞死亡和多种心血管疾病。然而,目前对心肌细胞DNA损伤修复的调节机制还知之甚少。
张岩和肖瑞平团队利用第三代测序和绝对定量质谱技术,首次发现人类心脏中最主要的CaMKII-d的可变剪切体是CaMKII-d9亚型,而不是以前广泛认为的d2和d3。利用病人心脏样本、人诱导多功能干细胞、以及多种大、小鼠心脏损伤模型,他们发现在心脏病理情况下,CaMKII-d9表达增加,直接结合并磷酸化FA通路唯一的泛素耦联酶E2T(Ubiquitin-conjugating enzyme E2T,UBE2T),并造成该蛋白的降解,从而损害FA通路的DNA修复功能,引起心脏DNA损伤和心肌细胞的死亡,进而引发心肌病和心力衰竭。CaMKII-d9特有的肽段是其特异性结合并降解UBE2T的基础,其它常见的CaMKII-d可变剪切体,包括d1、d2和d3,均不具备上述调控功能。
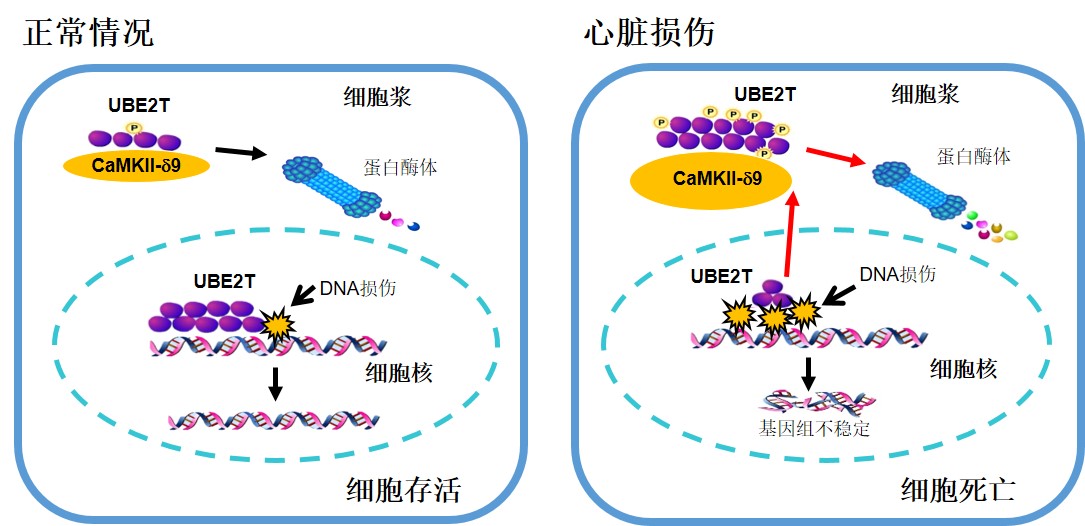
CaMKII-9调节心肌细胞DNA损伤和细胞死亡的机制:当心肌细胞受损伤时,CaMKII-9上调,促进UBE2T的磷酸化和降解,导致DNA修复障碍、DNA损伤的富集和基因组的不稳定,最终引起心肌细胞死亡
这项工作首次揭示了一种全新的CaMKII-d9依赖的心肌细胞DNA损伤和修复机制及其在心肌细胞死亡、心肌病和心力衰竭等重大疾病中的作用。研究提示,通过抑制该调控通路的过度激化,可为包括心脏缺血、恶性重构和心力衰竭等重大心血管疾病的预防和治疗提供新途径。
北京大学分子医学研究所张茂博士为该论文的第一作者,张岩为论文的通讯作者,肖瑞平为资深作者。北京大学分子医学研究所李川昀教授和胡新立副研究员、阜外医院宋云虎教授、国家蛋白质科学中心(北京)秦钧教授与安贞医院兰峰教授以及他们的研究团队为该工作提供了大力支持。这项研究得到科技部重点研发计划、国家自然科学基金委、北京市生命科学前沿创新培育项目、北京市自然科学基金、北大-清华生命科学联合中心、生物膜与膜生物国家重点实验室和北京市重点实验室的资助。
转载本网文章请注明出处
最新新闻
- 122025.07寰宇同窗,燕园远航 | 撒普尔:逐梦中国,搭建沟通中外的友谊之桥
- 122025.07总务部召开廉政教育会
- 122025.07习近平新时代中国特色社会主义思想研究院召开2025年春季学期期末全体教职工会议
- 122025.07阿拉伯文学经典中译与评论著作《〈悬诗〉疏评》座谈会在北京大学举行
- 122025.07北京大学信息科学技术学院举办2025年校友子女夏令营活动


