化学与分子工程学院陈鹏/樊新元课题组开发近红外生物正交光催化反应用于活体遥控分子激活(CAT-NIR)
2023/12/17 信息来源: 化学与分子工程学院
编辑:燕元 | 责编:燕元光控的生物正交反应能够利用外源光对生物活性分子进行原位可控的精准调控。这种原位光控调控已经成为化学生物学领域中的一项常见而有效的手段,广泛应用于研究生物功能以及调控生命过程等方面。其中,光源波长与反应基团直接相关。以邻硝基苄基为例,常用于紫外光脱除基团。然而,由于紫外光的细胞毒性等问题,研究人员开始寻找可见光响应的反应基团,如Bodipy、花青素等,这些基团可以在可见光的作用下触发脱除反应。然而,这些波长的光只能局限于细胞的研究中,因为无法穿透皮肤和脂肪组织,导致活体动物体内的遥控光控激活一直是一个巨大的挑战。
近红外光在光疗窗口内(700—1000nm)的波长具有良好的组织穿透性和生物相容性,因此被认为是遥控动物体内化学反应的理想光源。然而,由于能量较弱,近红外光难以直接触发化学反应,这也是目前需要解决的技术难题之一。近日,北京大学化学与分子工程学院陈鹏教授/樊新元副研究员课题组利用光催化反应的优势,借助近红外光敏剂作为光能中继站,开发了锇配合物作为催化剂,740nm近红外光触发苯硼酸转化为苯酚的近红外生物正交光催化反应(CAT-NIR技术),实现了使用体外的近红外光无损、遥控的控制小鼠体内生物活性分子的可控激活。
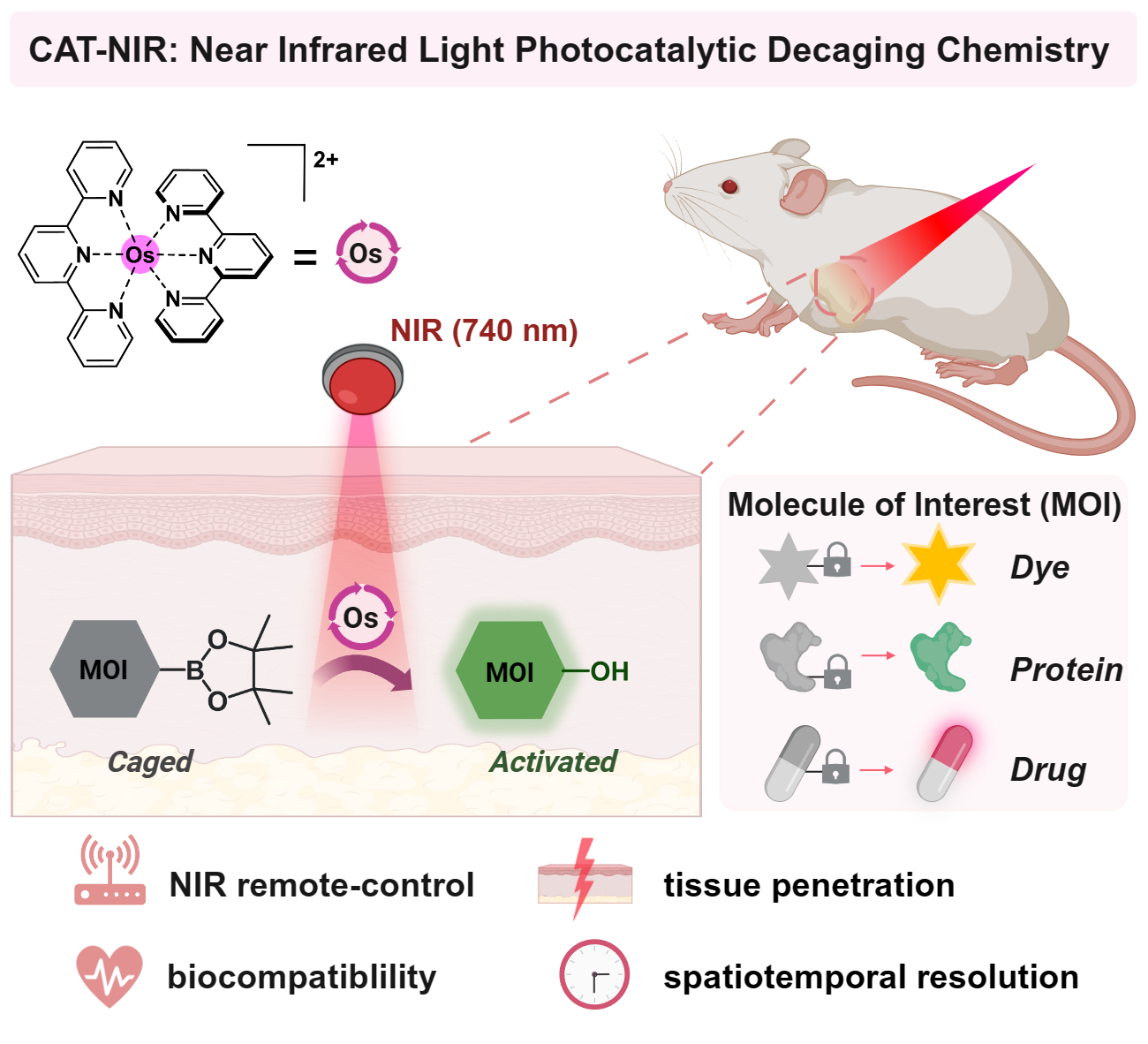
CAT-NIR技术示意图
该研究中,作者从光催化芳基硼酸氧化羟基化反应出发,在生物兼容的反应条件下,通过对光催化剂、添加剂、反应条件等进行系统的筛选和优化,以及对催化剂毒性、膜透性、胞内催化活性等一系列评估和考察,最终筛选出锇(II)三联吡啶配合物为最优催化剂,实现了生命环境中近红外光催化的硼酸高效脱除释放酚羟基的反应。随后的机理研究揭示了该光催化反应的可能途径:近红外光激发的锇催化剂被电子供体还原,随后经由单电子转移过程将分子氧活化为超氧化物,进而驱动芳基硼酸氧化羟基化反应,释放酚羟基的活性基团。

CAT-NIR化学反应开发
接着,作者借助该反应成功在活细胞体系实现了近红外光触发的荧光分子和前药分子的可控激活,展现出良好的生物相容性。为了将该反应进一步拓展至生物大分子,作者将其与遗传密码子拓展技术相结合,通过可控激活硼酸保护的蛋白质实现了活细胞表面蛋白-蛋白相互作用的调节和细胞的选择性标记。
最后,借助近红外光优异的组织穿透能力和反应的生物相容性,作者成功在荷瘤小鼠模型中远程可控地激活了前药分子,实现了利用体外的近红外光遥控激活活体动物体内的活性分子。
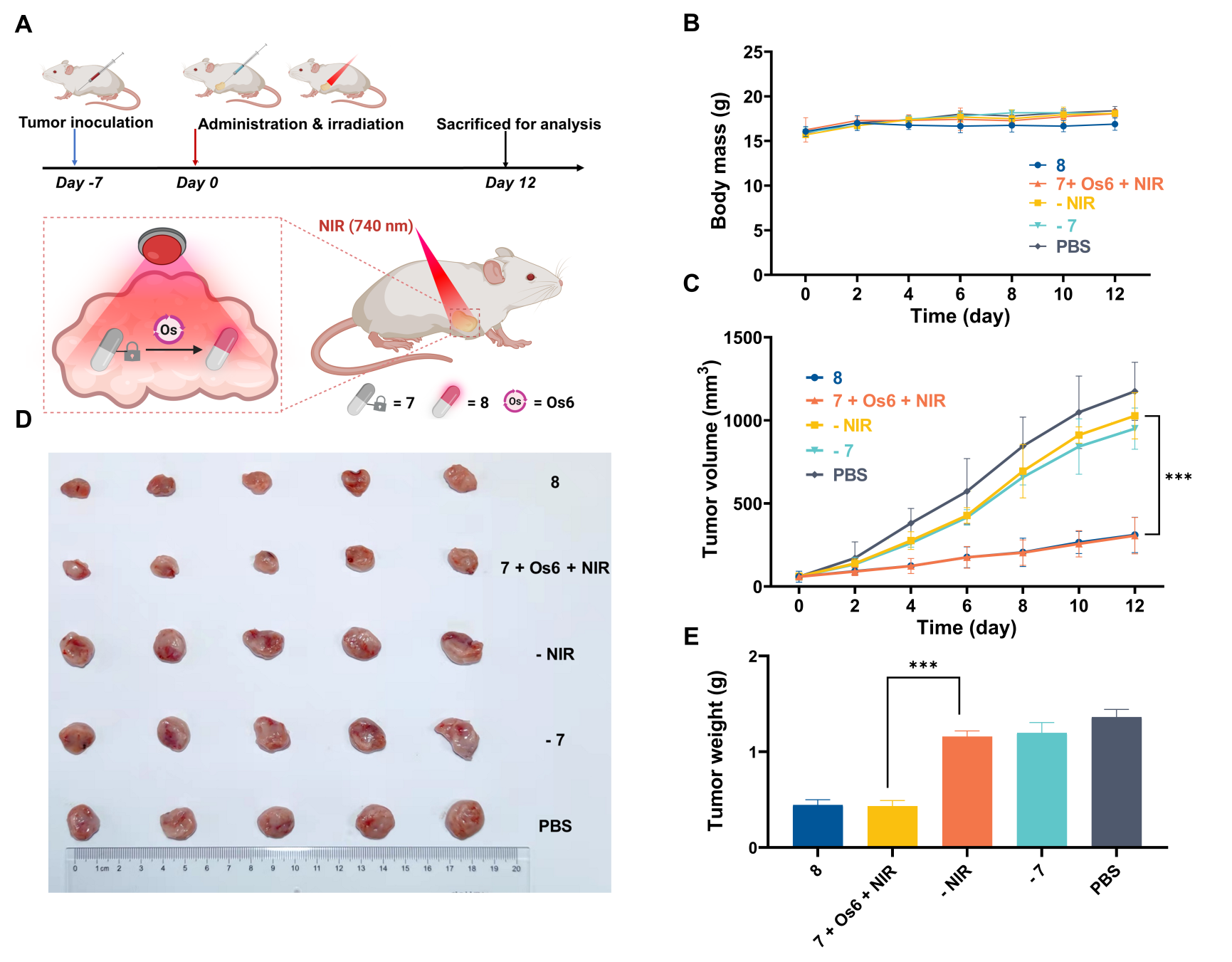
CAT-NIR用于活体小鼠中前药分子的遥控激活
综上,该工作借助光催化策略,开发了近红外光触发的生物正交光催化反应,并应用于活细胞中荧光分子、前药和蛋白质等功能分子的可控激活。更为重要的是,得益于近红外光的组织穿透能力,该工作实现了活体动物体内功能分子的遥控激活。
该工作以“Near Infrared Light-Triggered Photocatalytic Decaging for Remote-Controlled Spatiotemporal Activation in Living Mice”为题发表在Angew. Chem. Int. Ed. 上(Angew. Chem. Int. Ed. 2023, e202310920)。论文的通讯作者是陈鹏和樊新元,第一作者是北大-清华生命科学联合中心2020级博士生梁轩和西华大学钱珊教授,北京大学化学与分子工程学院娄之正、侯雨辰等同学也作出了重要贡献。该研究得到国家自然科学基金委、科技部重大专项、李革赵宁生命科学青年基金等项目的支持。
转载本网文章请注明出处