生命科学学院赵进东、高宁与合作者揭示CpcL藻胆体能量传递机制
2023/08/03 信息来源: 生命科学学院
编辑:悠然 | 责编:安宁2023年7月5日,北京大学生命科学学院赵进东院士课题组与高宁教授课题组,以及中国科学院物理所翁羽翔研究员课题组在Nature Communications上发表了题为“Cryo-EM and femtosecond spectroscopic studies provide mechanistic insight into the energy transfer in CpcL-phycobilisomes”的研究论文。论文利用冷冻电镜技术首次解析了集胞藻(Synechocystis sp. PCC 6803)CpcL藻胆体(Phycobilisomes,PBS)的高分辨结构,确定了蓝细菌藻胆体中色素基团(bilin)的不同构象,结合超快光谱实验确认了在能量吸收中起关键作用的bilin的构象并证实了它在能量传递中的作用。
蓝细菌是最早将太阳能转化为化学能的生物种群之一,是24亿年前地球上氧气含量上升的原因。蓝细菌对光能的捕获主要通过藻胆体完成,并将捕获的光能传递给光系统II(PhotosystemII, PSII)或者光系统I(PhotosystemI, PSI)。蓝细菌中的藻胆体存在两种类型,CpcG-PBS和CpcL-PBS。CpcG-PBS由核心(Core)和外周杆(Rods)组成,外周杆通过连接蛋白CpcG附着在核心周围。相比之下,CpcL-PBS具有更小的尺寸,只包含一个外周杆,并不存在核心部分。CpcL-PBS通过连接蛋白CpcL与光合膜连接,与PSI相互作用并可以将吸收的能量传递给PSI。CpcL-PBS还参与NAD(P)H脱氢酶-CpcL-PBS-PSI(NDH-PBS-PSI)超复合物的形成,并对于环式电子传递(Cyclicelectrontransfer,CEF)不可缺少1,同时CEF也需要铁氧还蛋白-NADP+氧化还原酶(Ferredoxin-NADP+oxidoreductase,FNR)和CpcL-PBS的相互作用2。FNR可以附着在CpcG-PBS或者CpcL-PBS的外周杆上,但是已经报道的CpcG-PBS的结构中并没有发现FNR的存在。尽管对于CpcG-PBS的能量传递机制研究者在2021年已有报道3,但是对于CpcL-PBS向PSI的能量传递机制以及CpcL-PBS在NDH-PBS-PSI超复合物形成中的作用研究尚不清楚。
本研究利用冷冻电镜技术解析了Synechocystis sp. PCC 6803的CpcL-PBS的高分辨结构。该结构显示,CpcL-PBS复合物主要组成形式为三层圆盘的垛堞结构(图1a—c),每层圆盘的主体部分由CpcA和CpcB的异源六聚体组成,圆盘之间通过四种不同类型的连接蛋白(CpcL、CpcC1、CpcC2、FNR)连接起来,其组成类似于线性结构(图1d,e)。CpcL-PBS与CpcG-PBS的外周杆很相似(图1f)。在CpcL-PBS复合物中,CpcL靠近类囊体膜,而FNR则位于CpcL-PBS复合物的末端(图1g),这也是首次在已解析的藻胆体结构中发现FNR蛋白。
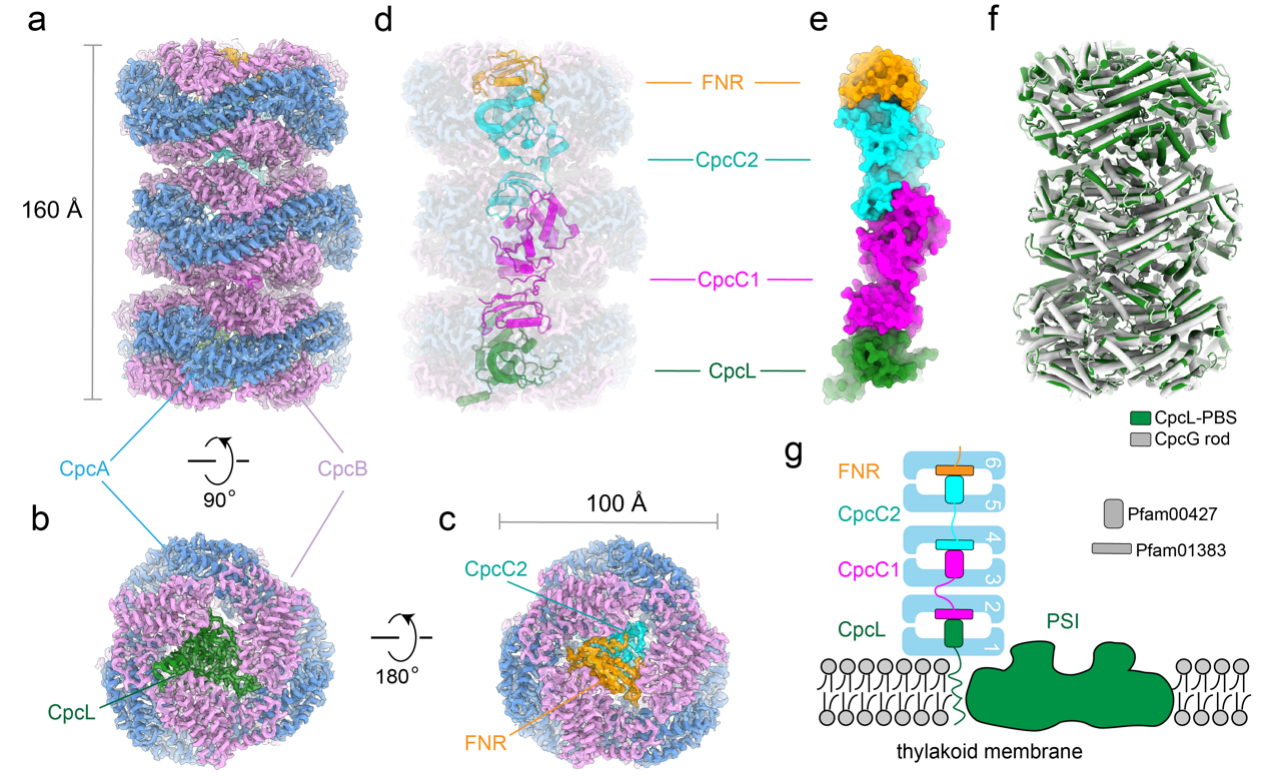
图1 Synechocystis 6803 CpcL-PBS复合物结构
尽管CpcL-PBS和CpcG-PBS的外周杆高度相似,但是CpcL-PBS在室温荧光上有一个668纳米的发射峰,这相比于CpcG-PBS外周杆的发射峰有一个相当明显的红移。之前对于远红外光适应物种的研究发现光的红移可能和bilin的构象有关4。为了探明CpcL-PBS复合物红移的原因以及CpcL-PBS是如何将能量传递给PSI的,研究者分析了CpcL-PBS复合物中bilin的构象。结构分析发现,CpcL-PBS复合物中的bilin的构象不尽相同,这种差异化的bilin主要集中分布在连接蛋白的周围(图2a,b)。在CpcG-PBS复合物的研究中,研究者已经报道了连接蛋白在能量传递中的作用3,通过CpcG和CpcL-PBS中对应位置bilin构象的比较,研究者发现,bilin的差异化主要表现在bilin的RingC和RingD的变化上(图2c,d)。而RingC和RingD是bilin和连接蛋白相互作用的区域,在CpcL-PBS和CpcG-PBS的外周杆中,这种bilin的差异性来源于bilin的RingC和RingD和连接蛋白CpcL或者CpcG相互作用的结果,表明连接蛋白可以调节bilin的能量状态,从而使得bilin的能级和光谱存在不同。
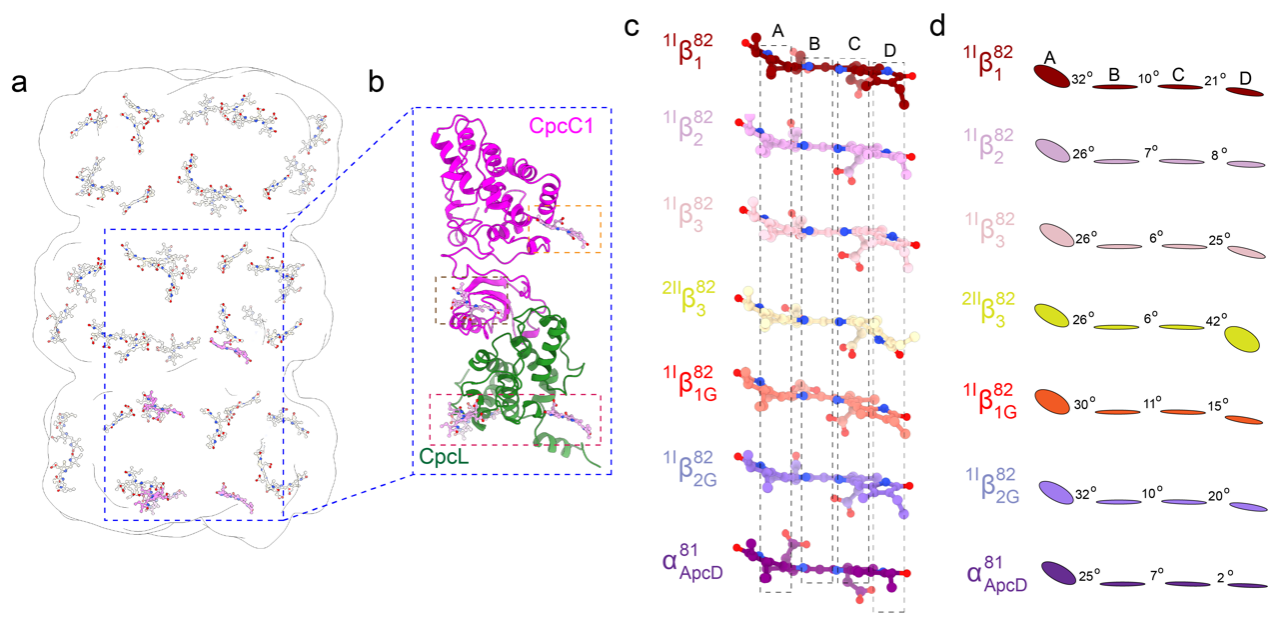
图2 CpcL-PBS中bilin的分布以及一些关键bilin的构象
为了进一步探究CpcL-PBS能量传递的动态特性,研究者采用超快光谱的方法去研究CpcL-PBS中激子的迁移(exciton migration)。之前对于蓝细菌Synechocystis 68035和Anabaena 71206的CpcL-PBS到PSI能量传递的研究发现,CpcL-PBS中存在“redbilin”并且对于CpcL-PBS的能量传递非常重要。本研究采用飞秒时间分辨的瞬态吸收光谱(Femtosecond time-resolved transient absorption spectroscopy)研究完整的CpcL-PBS的光谱学性质(图3a—c),结果显示组分P1有3.6ps的衰减时间(decaytime),并且在631nm处存在吸收漂白,在671nm处存在一个正吸收峰。组分P2有40ps的衰减时间,在637nm处存在吸收漂白,在675nm处存在一个正吸收峰。组分Rs和RL有一个中等的衰减时间为200ps,它们的吸收漂白分别在644nm和668nm处。最慢的组分T衰减时间大于1200ps,并且在669nm处存在吸收漂白(图3c)。这些结果表明,CpcL-PBS的能量迁移发生在皮秒时间范围内,并按照如下方式传递:P1(3.6ps)/ P2(25ps) → RS/RL (200ps) → to T (>1200 ps)。

图3 CpcL-PBS的超快吸收和荧光光谱分析
研究者进一步采用皮秒时间分辨荧光光谱技术(Picosecond time-resolved fluorescence spectroscopy)研究CpcL-PBS的能量转移(图3d—f)。衰减相关谱(Decay-associated spectra,DAS)和成分相关谱(Species-associated spectra,SAS)如图3d和3e所示,结果显示有三种成分相关光谱,并且它们的衰减时间常数分别为101ps,401ps和1999ps。时间常数为401ps的SAS由两个成分组成,一个峰值在651nm,另一个峰值在669nm(图3e)。因此这些成分在能量转移中的动力学如下所示:C645nmà C651nm/C669nmà C672nm(C: component)。
结合冷冻电镜技术解析的CpcL-PBS的结构,作者推出了在CpcL-PBS中常规的bilin到“red bilin”的能量转移过程。在飞秒时间分辨的瞬态吸收光谱中,组分P1应该为所有的bilin α84和β155,因为它们几乎不与连接蛋白相互作用,预计有最短的漂白波长。组分P2在637nm处有一个漂白峰,应该是除去最底部的三个bilinβ82剩下的所有的bilinβ82,它们位于六聚体的空腔内部,并且和连接蛋白相互作用。Rs和RL分别被指定为bilin 1Iβ823和1Iβ821,它们具有相同的衰减常数(200ps),但是RL在668nm有更明显的红移吸收漂白。这是因为相比于bilin1Iβ823,bilin1Iβ821和连接蛋白CpcL存在更多的相互作用,并且RingC和RingD之间的角度更小,平面性更强。组分T被分配为bilin1Iβ822,它具有最强的平面性,是CpcL-PBS复合物中的“red bilin”,负责能量向PSI的传递。同样的,在皮秒荧光光谱中,除了三个独特的bilin1Iβ82,所有的荧光发射合并为C645nm(100ps),bilin1Iβ823(RS)和bilin1Iβ821(RL)的发射光谱为C651nm/C669nm(401ps),bilin1Iβ82(T)的发射光谱为C672nm(1999ps),这些结果清晰地表明CpcL-PBS含有终端发射的“redbilin”可以将能量直接传递给PSI。
综上所述,本研究证明了FNR蛋白位于CpcL-PBS的最远端,并且结合了飞秒瞬态吸收光谱和皮秒荧光光谱实验证明了单个bilin在能量传递中的作用,同时揭示了bilin1Iβ822作为“red bilin”是CpcL-PBS复合物中的能量陷阱,负责将能量传递给PSI。本研究对于理解其它类型藻胆体的能量传递机制提供了关键信息,也为捕光复合物中蛋白-色素的相互作用和高效的能量迁移研究提供了一个代表性的实验体系。
赵进东和高宁以及翁羽翔为本文的共同通讯作者。郑吕钦(高宁组),张正东(赵进东组),王宏蕊(赵进东组),郑正高(赵进东组)为该研究论文的共同第一作者。本研究得到了国家重点研发计划、国家自然科学基金委、北大-清华生命科学联合中心、膜生物学国家重点实验室、蛋白质与植物基因研究国家重点实验室和北京大学生命科学学院启东产业创新基金的经费支持,以及冷冻电镜平台、北京大学电镜实验室、高性能计算中心、生科院仪器中心及凤凰工程的技术支持。
1.Gao, F.D., Zhao, J.H., Chen, L.P., Battchikova, N., Ran, Z.X., Aro, E.M., Ogawa, T., and Ma, W.M. (2016). The NDH-1L-PSI Supercomplex Is Important for Efficient Cyclic Electron Transport in Cyanobacteria. Plant Physiology 172, 1451-1464. 10.1104/pp.16.00585.
2.Li, X.Y., Huang, C.H., Wei, P.J., Zhang, K., Dong, C.X., Lan, Q., Zheng, Z.G., Zhang, Z.D., and Zhao, J.D. (2022). Attachment of Ferredoxin: NADP(+) Oxidoreductase to Phycobilisomes Is Required for Photoheterotrophic Growth of the Cyanobacterium Synechococcus sp. PCC 7002. Microorganisms 10. ARTN 1313 10.3390/microorganisms10071313.
3.Zheng, L., Zheng, Z.G., Li, X.Y., Wang, G.P., Zhang, K., Wei, P.J., Zhao, J.D., and Gao, N. (2021). Structural insight into the mechanism of energy transfer in cyanobacterial phycobilisomes. Nat Commun 12. ARTN 549710.1038/s41467-021-25813-y.
4.Soulier, N., and Bryant, D.A. (2021). The structural basis of far-red light absorbance by allophycocyanins. Photosynth Res 147, 11-26. 10.1007/s11120-020-00787-y.
5.Niedzwiedzki, D.M., Liu, H., and Blankenship, R.E. (2019). Excitation Energy Transfer in Intact CpcL-Phycobilisomes from Synechocystis sp. PCC 6803. J Phys Chem B 123, 4695-4704. 10.1021/acs.jpcb.9b02696.
6.Noji, T., Watanabe, M., Dewa, T., Itoh, S., and Ikeuchi, M. (2021). Direct Energy Transfer from Allophycocyanin-Free Rod-Type CpcL-Phycobilisome to Photosystem I. J Phys Chem Lett 12, 6692-6697. 10.1021/acs.jpclett.1c01763.
转载本网文章请注明出处